- Berber Rouwé (2009), Kankercellen ontaarden door met veel 'touwtjes' aan chromosomen te trekken
NRC 13 juni, p. W7. (zie heronder) - Oud, O. and Rickards, G. (1999). Understanding Mitosis and Meiosis.
Een interactieve CD-ROM. ISBN 3 540 14819 1. - Marcel aan de Brugh (1999), De celdeling gecontroleerd. NRC. (zie hieronder)
De uitleg over bevruchting, mitose, meiose I en II herhaald.
(Zie virtual
biology)
Kankercellen ontaarden door met veel 'touwtjes' aan chromosomen te trekken
Ongecoördineerd touwtrekken aan chromosomen zorgt ervoor dat kankercellen steeds verder ontsporen, denken onderzoekers uit Boston. Kankercellen hebben vaak meer, of juist minder chromosomen dan gezonde cellen. Dat komt vooral doordat de draden die de chromosomen tijdens de celdeling uit elkaar moeten trekken niet goed werken (Nature, 7 juni). Die ongelijke chromosoomverdeling (chromosoominstabiliteit) zorgt ervoor dat kankercellen steeds verder ontsporen en uitzaaien of ongevoelig worden voor behandeling.
De kern van een gezonde menselijke cel bevat 46 chromosomen. Vlak voor de celdeling worden al die chromosomen gekopieerd, zodat elk chromosoom uit twee chromatiden bestaat. Tijdens de kerndeling worden de chromatiden uit elkaar getrokken, naar twee kanten (de polen) van de cel. Vervolgens splitst de cel zich. Beide dochtercellen krijgen ieder 46 chromatiden, die weer tot chromosomen uitgebouwd kunnen worden.
Voor het trekwerk gebruikt de cel spoeldraden, bundels van lange eiwitten die ontstaan uit spoellichaampjes.
(In eukaryote cellen ligt net buiten de kernmembraan het centrosoom een gebied waarin bij dierlijke cellen de twee centriolen liggen. De centriolen verdubbelen zich in het begin van de profase en bewegen zich dan elk langzaam naar één kant van de kern. Geleidelijk ontwikkelt zich uit elk van de centrosomen een structuur van draden. Deze draden zijn gemaakt van microtubuli (Lat.: tubuli 'buisjes'). Een aantal evenwijdig lopende microtubuli vormt samen bundels, spoeldraden genaamd, die groot genoeg zijn om met de lichtmicroscoop te zien. De microtubuli zijn gemaakt van het eiwit tubuline. Als de centrosomen met de centriolen elk aan één kant van de kern aangekomen zijn, is er een netwerk van draden ontstaan die de gehele kern omspant. Dit wordt spoelfiguur genoemd. De spoelfiguur is voltooid aan het begin van de metafase, het moment dat alle chromosomen zich in het equatoriale vlak van de cel bevinden.)
De twee polen van de celkern hebben elk zo'n spoellichaampje. Kankercellen hebben vaak meer dan twee spoellichaampjes. Hoe een overschot aan spoellichaampjes kan leiden tot chromosoom instabiliteit, was tot nu toe onbekend. Onderzoekers van Harvard Medical School kleurden de spoellichaampjes, spoeldraden en chromosomen met fluorescerende stoffen en filmden celdelingen onder de microscoop.
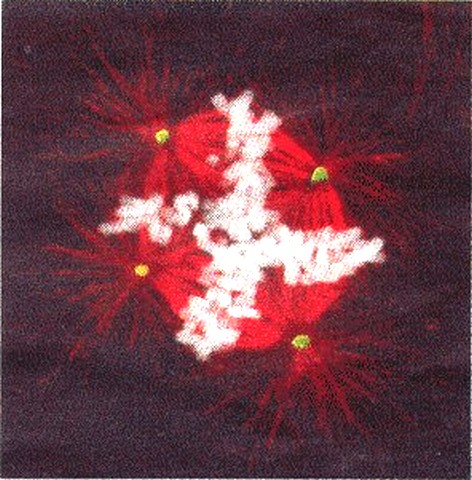 |
| Kankercel met vier spoellichaampjes leidt tot gevaarlijke chromosoomverdeling |
Ze ontdekten dat de overtollige spoellichaampjes zich ruim voor de celdeling verspreiden over de celkern. Elk spoellichaampje maakt trekdraden die willekeurig worden vastgeknoopt aan de dichtstbijzijnde chromosomen.
Vlak voor de eigenlijke deling ontdekt de cel deze fout en gaat reorganiseren. De extra spoellichaampjes worden bij
elkaar geveegd tot er weer twee polen ontstaan. De draden die al aan chromosomen vast zitten, raken hierdoor in de
war. Het ontaardt in chaos. Sommige chromosomen worden gevierendeeld. Andere blijven in het midden hangen
tot één van de verbindingen het begeeft en het chromosoom willekeurig in de ene of de andere dochtercel
terecht komt. De onderzoekers denken dat deze mislukte reorganisarie dé oorzaak is van chromosoom instabiliteit
bij kankercellen.
Berber Rouwé
DE CELDELING GECONTROLEERD.
Het basisprincipe van de celdeling kennen we. Maar er blijven nieuwe aspecten bijkomen
die het achterliggende, moleculaire mechanisme compliceren. De ontdekking
van de 'vuilnisdienst' bijvoorbeeld. Veel werk laat zien dat de celcyclus ons nog steeds
blijft verrassen.
Een aantal jaren later trok Nurse (van het Kankerinstituut in Londen) wereldwijde aandacht met zijn werk aan het cdc-2-gen (cdc staat voor cell- division cycle). Het eiwitprodukt van dit gen blijkt cruciaal voor een gistcel om de mitotische fase in te gaan. Maar wat opvallender was, de celbioloog bewees dat er een menselijke variant van cdc-2 moest zijn. Hij introduceerde namelijk allerlei stukjes menselijk DNA in Schizosaccharomyces pombe. Bij toevoeging van één bepaald stukje bleek de gistcel prompt de mitotische fase in te gaan. Eind jaren tachtig werd deze, menselijke variant, genaamd cdk-1, geïsoleerd.
Vier stadia.
De laatste jaren is het snel gegaan. In een razend tempo zijn de belangrijkste spelers in de celcyclus opgespoord. Er blijkt een grote homologie te bestaan door het hele dieren- en plantenrijk heen. Het kost een zoogdiercel ongeveer 24 uur om door de vier stadia (G1, S, G2 en M) te komen. Iedere fase kent zijn specifieke taken en daarbij lijkt een strikt afgebakende set van eiwitten en genen te horen. Van gist tot mens vertoont die set grote overeenkomsten.
In de eerste fase, G1, 'kiest' de cel uit drie mogelijkheden: delen, rusten of
differentiëren. De keuze wordt de cel min of meer opgelegd, afhankelijk van
de signalen die ze van buitenaf opvangt. Zo zijn er allerlei groeifactoren
(EGF - epidermal growth factor, PDGF - platelet-derived growth factor,
ILGF - insulin-like growthfactor) die de celdeling stimuleren, terwijl
bijvoorbeeld TGFb - (transforming growth factor b of ook groei-inhibitiefactor b
genoemd) de deling remt.
Als de cel eenmaal gekozen heeft om zich te gaan delen, kan hij niet meer
terug. Het is onmogelijk dat de cel bijvoorbeeld tijdens het verdubbelen van
het DNA (tijdens de S-fase) ineens stopt en zich alsnog gaat differentiëren.
Is de G1-fase eenmaal gepasseerd dan wikkelen de daaropvolgende fasen (S,
G2 en M) zich als vanzelf af, zodat zich uiteindelijk twee cellen vormen
waar er eerst een was.
Cyclisch gedrag
Iedere fase kent typische eiwitten. Sommige duiken steevast in één bepaalde
fase op, om even later weer net zo snel te verdwijnen. Ze worden derhalve
cyclines genoemd. Tot op heden zijn er zeven bekend. Van vier - cycline
A, B, D en E - weet men wanneer ze actief zijn en wat hun functie is in de
celcyclus.
Vanwege hun cyclische gedrag dichtte men de eiwitten in eerste instantie een
klokfunctie toe. De cel zou aan het type cycline als het ware kunnen zien
'hoe laat' het is. De rol van de cyclines bleek echter minder passief.
Celbiologen weten inmiddels dat de moleculen de celcyclus actief sturen.
Cyclines kunnen echter niks beginnen zonder de hulp van de zogenaamde
CdK's (cycline dependent kinase's). Kinases zijn enzymen die andere
eiwitten kunnen activeren. Ze doen dat door een fosfaatgroep over te
hevelen van ATP naar het te activeren eiwit. Edmond Fischer en Edwin
Krebs helderden dit basismechanisme midden jaren vijftig op en kregen
hiervoor in 1992 de Nobelprijs voor Fysiologie.
Het uitschakelen van eiwitten (het weer verwijderen van de fosfaat-groep)
gebeurt door een andere groep van enzymen, de fosfatases. Hun
werkingsmechanisme werd begin jaren veertig opgehelderd door het echtpaar Cari en
Gert Corti. In 1947 kregen ze voor hun ontdekking de Nobelprijs voor
Fysiologie. Is een cycline-CdK-complex eenmaal geactiveerd dan kan het op
zijn beurt een ander eiwit(complex) activeren. Zo activeert het
cyclineD-CdK4-complex het cyclineE-CdK2-complex dat op zijn
beurt - via fosforylering van het zogenaamde
retinoblastoma-eiwit - het eiwit E2F aanschakelt.
Deze transcriptiefactor activeert meerdere genen. Dat is de laatste stap in de
Gl-fase.
In de S-fase volgt verdubbeling van het DNA. In deze fase duikt cycline A ineens op. Deze variant kan een complex vormen met CdK2. Tot op heden is niet duidelijk wat het complex precies doet, maar men mag verwachten dat het samenhangt met DNA-duplicatie.
In de daaropvolgende G2-fase wordt gecontroleerd of de DNA-verdubbeling goed is verlopen. Als dat inderdaad zo is, geeft cycline B de aanzet tot afbraak van de kernmembraan. Hierdoor komen de chromosomen vrij in het cytoplasma te liggen zodat ze tijdens de volgende fase, de mitose, netjes verdeeld kunnen worden over de twee dochtercellen.
Op het eerste gezicht lijkt dit alles nog redelijk overzichtelijk. Maar helaas,
de cel zit moeilijker in elkaar. Zo'n twee jaar geleden kwamen de eerste
aanwijzingen dat cycline-CdK-complexen niet zonder meer werken. Zij staan
onder controle van de zogenaamde CdKi's (CdK-inhibitor) die op hun beurt
onder invloed staan van een externe (groei-inhibitiefactor TGF13) of interne
boodschapper (het eiwit p53). Vorig jaar augustus meldde Science de
ontdekking van een mechanisme dat een cruciale rol speelt bij de celdeling.
Het betreft de ubiquitine-route, volgens Science beter bekend als 'the cell's
garbage disposer'.'Disposer' omdat ubiquitine aan eiwitten hecht en ze
daarmee merkt voor afbraak; 'garbage' omdat het hierbij meestal om
beschadigde of misvormde eiwitten gaat. Maar ubiquitine blijkt ook de
cyclines te merken, vandaar dat ze zo plotsklaps kunnen verdwijnen. Door
deze ontdekking heeft ubiquitine ineens een heel andere status gekregen.
'Het is een van de meest opwindende gebieden van het huidige celcyclusonderzoek,'schreef
Science een half jaar geleden.
Ook het werk van dr. Roderiek Beijersbergen, verbonden aan het Nederlands Kanker
Instituut, laat zien hoe complex het mechanisme in elkaar zit.
De Amsterdammer richtte zich op het eiwit E2F dat actief is in de G1-fase.
Mede door het werk van Beijersbergen werd duidelijk dat er meerdere
varianten van E2F voorkomen (inmiddels zijn er vijf bekend). Elke variant
wordt op zijn eigen wijze gecontroleerd. De varianten 1, 2 en 3 binden
bijvoorbeeld aan het eiwit pRb, een bekend eiwit dat de celdeling kan onderdrukken.
E2F-4, het molecule waar de Amsterdammer zijn aandacht op
richtte, blijkt gecontroleerd te worden door twee andere eiwitten, p107 en p130, die qua
structuur erg veel op pRb lijken. Door hun binding aan E2F-4
blokkeren ze de signaaldoorgave, en dus de celdeling.
Normaalgesproken vormen E2F-4, p107 en p130 een complex, maar aan het eind van de Gl-fase worden p107 en p130 in korte tijd gefosforyleerd. Daardoor ontkoppelen ze van E2F-4 die op dat moment meerdere genen kan aanschakelen. Voor zijn werk ontving Beijersbergen drie weken geleden de Antoni van Leeuwenhoekprijs (f. 12.500,-).
Kanker
De celdeling is een hot item in de biologie, niet in de laatste plaats vanwege zijn betekenis voor het kankeronderzoek. Veel van de eiwitten die een rol hebben in de celcyclus, zijn in gemuteerde vorm betrokken bij het ontstaan van kanker. De eiwitten pRb, p53 (tumorsuppressor-genen) en E2F (oncogen) zijn hierin centrale spelers.
Naarmate het onderzoek vordert verschijnen er echter steeds meer op het
toneel. Ze laten zien dat het totale mechanisme van de celdeling nog
geenszins is opgehelderd en dat er in de toekomst nog een heleboel nieuwe
eiwitten ontdekt zullen worden die bij dit essentiële biologische proces actief
zijn.
Vandaar dat de Britse celbioloog Paul Nurse bij zijn aanstelling als nieuwe
directeur van het Imperial Cancer Research Fund liet weten dat hij het
fundamenteel onderzoek een nieuwe impuls wil geven. 'Mijn voorgangers
dachten dat we genoeg fundamenteel onderzoek aan kanker hadden gedaan,'
zei hij onlangs in Nature. 'Ik vind echter dat we nog steeds te weinig weten,
en dat fundamenteel onderzoek doorgezet moet worden.'