- Lucas Brouwers (2012), DNA wordt niet ouder dan 7 miljoen jaar
NRC 13 okt 2012, p. W 2. (Zie voor artikel hieronder.) - Lucas Brouwers (2011), Biologieles: zelf aan de schepping knutselen
NRC 4 febr., p. 4. (Zie art. hieronder). - Wim KŲhler (2010), Oogsttijd voor genenzoekers
NRC 13 feb. 2010, p. W. 8-9. (Zie hieronder voor art.) - Valerie Notenboom (2009) - Turbo-DNA (sequencing)
NWT jrg. 77, sept. 2009, p. 60-66. (Zie hieronder een deel van dit artikel) - Huup Dassen (2009) - MicroRNA bestrijdt leverkanker bij muizen effectief.
NRC 13 juni, p.W. 13 (Art. zie hieronder) - Michiel van Nieuwstadt (2009) - Nieuw bewijs voor de theorie dat het leven uit RNA is voortgekomen.
NRC 16 mei, p. W. 7. - Hans van Maanen (2004). Hoe cellen kiezen tussen eigen en vreemd.
Andrew Fire ontrafelde RNA-interferentie. (Heinekenprijs)
Volkskrant 2 okt. 2004 p.3W.
Artikel zie hieronder. - Huub Dassen (2004). RNA interferentie geneest muizen van zenuwziekte.
NRC 17 juli 2004 p. 18. (Zie hieronder voor het complete artikel.) - Wim KŲhler (2002). RNAi breekt door.
NRC 21 dec. p. 38 (Zie hieronder voor complete artikel.) - Rob van den Berg (2002). Lichtschakelaar activeert de genen naar believen.
NRC 7 sep. p.40. (Zie hieronder het complete artikel). - Sander Voormolen (2001). Verborgen schakelaars - Vreemd RNA controleert ingeprente genen.
NRC 27 okt p. 42.
Variabele methylering kan vaderlijke of moederlijke genen bevoordelen. - SNP's makkelijker op te sporen.
Bionieuws 9 juni 2001, p.3.
SNP's (spr. 'snips') - single nucleotide polymorphisms; het zijn de basenparen die het verschil tussen individuen bepalen. - Sander Voormolen (2001). Zoek de verschillen.
NRC 2 juni, p.43. - Rob Meijers (2001). De mismaakte metafoor van DNA als Heilige Graal.
Natuur en Techniek, juni, p. 66-67. - Wolfgang Hachtel und Silvia Berger (2001). Genetischer Steckbrief eines Plflanzenschädlings.
Spektrum der Wissenschaft, juni, p. 12-14. - Gaby van Caulil (2001). RNA kan maar beter alleen blijven.
Bionieuws 8, 28 april, p. 1 en 5.
RNA-interferentie beschermt tegen 'springende genen'. - Jan Frings (2001). DNA als identificatiemiddel.
NVOX nr.4 apr., p.202-205. - Marten Mulder (2001). Eerst DNA, dan asiel. - Als paspoorten ontbreken,
kan DNA-onderzoek het bewijs leveren voor een gezinsband.
Bionieuws, 14 april, p. 5. - Erik Hermkens (2001). Biddende eiwitten.
Mens en Wetenschap, 28 (1), p. 28.
DNA-reparatie-systeem. - Rob van de Berg (2001). Evolutie in de reageerbuis levert verbeterde eiwitten.
NRC. 7 april. p. 57, k.6-7. - Dr. J. Kok (2001) - Moleculaire biologie - Oorzaak van een revolutie in de
medische levenswetenschappen.
NVON 26 jrg feb. nr. 2. p.72-74. - Gaby van Caulil (2001). We missen nog een snelle detectiemethode.
Genetici willen grootschalig SNP's kunnen aantonen.
Bionieuws 20 jan. p.9.
Verschillende detectiemethoden worden genoemd. - Dr. Peter de Knijff (2000). DNA voor de rechtbank.
Natuur en Techniek april, p. 82-83.
Uitleg over STR = short tandem repeats. - Jos van den Broek (2000), RNA blijft verrassen.
Natuur en Techniek oktober, p.8
Een enkele RNA-sequentie kan zich vouwen tot twee verschillende ribozymen. - Wouter Klijn (2000). DNA-test maakt vooral de partner depressief.
Volkskrant 11 nov. p.5W, k.1-5. - Jos van den Broek (2000). Nanobuis zoekt genetische afwijkingen.
Natuur en Techniek, okt. p.14. - Jos van de Broek (2000). RNA blijft verrassen.
Natuur en Techniek, okt. p.8. - Sander Voormolen (2000). In de eiwitfabriek - RNA
katalyseert de eiwitsynthese. NRC 12 aug. p.31, k.1-7.
- Ronald Plasterk (2000). De taal van de schepping.
Volkskrant 12 aug 2000. - Wim KŲhler (2000). Touw in een doosje. Spiraal is de
ideale vorm voor lange moleculen.
NRC 22 juli. p.37.
- Cisca Wijmenga en Alfons Bardoel (2000). Genen lezen.
Natuur en Techniek Jrg. 68. juli/aug. p.108-109.
Zie ook: www.ornl.gov/hgmis/publicat/primer/prim2.html Dit vertelt over het Human Genome Project.
De website van Medische Genetica is te vinden op
humgen.med.uu.nl. - Peter Raeymakers (2000). DNA-cocktail uit een kiwi.
Natuur en Techniek Jrg. 68. juli/aug. p.110-111.
Een doe het zelf DNA proefje dat binnen een uur te klaren is. Deze proef werd met toestemming van Leen Leus overgenomen en aangepast uit het 'Lespakket Biotechnologie, uitgegeven door AGRINFO, FEVIA, OIVO en VIB en gericht op leerkrachten van het middenonderwijs. Het bevat nog andere interessante informatie over DNA en biotechnologie. Het is aan te vragen via katrien.coucke@vib.be of toegankelijk via www.vib.be. Andere proeven met DNA zijn te vinden op www.eibe.org/ENGLISH/U1.HTM. - Huup Dassen (2000). Genetische bestrijding van malaria
mogelijk.
NRC 24 juni. p.51. k.7. - Wim KŲhler (2000). 'Op het gebied van genetica heb je geen
keuze.' - Louise Gunning-Schepers over de toepassing van
gentherapie.
NRC 24 juni. p.51, k.1-6. - Marianne Hesselmans (2000). BŤtawaaier vol leven -
DNA-technieken leiden tot een stroom van nieuwe studies.
NRC 24 juni p.53, k.1-8. - Sander Voormolen (2000). Stille genen zijn minder zeldzaam dan
altijd aangenomen.
NRC 24 juni. p.51. k.7. - Rob van den Berg (2000). De mens op een chip. DNA-chips maken
revolutie gentechnologie mogelijk.
NRC 24 juni. p.57. k.1-5. - Maarten Evenblij. 2000. Rekenkracht uit de chromosomen.
Volkskrant 17 juni. p.7W. k.1-5. - Marcel aan de Brugh. (2000). Bubble-jet-printer spuit DNA-druppels op
glasplaatje van 4 cm2.
NRC 8 apr. p.57. - Gaby van Caulil (1999). Genetica in het geding.
Bionieuws, 28 aug. p.5. (Zie hieronder de uitleg over STR's - de Short Tandem Repeats). - Marcel aan de Brugh (1993). Gespleten genen vormen evolutionaire
blokkendoos.
Intermediair 10 dec. p. 35. (Zie hieronder)
DNA wordt niet ouder dan 7 miljoen jaar
Lucas Brouwers in NRC 13 okt. 2011, p. Wet. 2.
Wie het klonen van dinosauriŽrs uit oud DNA in Jurassic Park ongeloofwaardig vond, heeft nu ook de wetenschap aan zijn zijde. DinosauriŽrs, uitgezonderd van vogels, stierven 65 miljoen jaar geleden uit. Maar zelfs in het gunstige geval, waarin een bot bij een temperatuur van minus 5 graden Celsius bewaard blijft, is na 7 miljoen jaar vrijwel al het DNA vergaan. Dat blijkt uit onderzoek naar het verval van DNA dat woensdag in Proceedings of the Royal Society B verscheen.
Een DNA-molecuul bestaat uit een lange keten van aaneengeritste baseparen, opgeborgen in de kern van een cel. Zodra de cel sterft, begint de DNA-keten uit elkaar te vallen. In eerste instantie hakken knipenzymen de streng in grove stukken, later verliest de streng zijn basen door chemische reacties. Het verval van DNA-fragmenten verloopt exponentieel, net als het verval van radioactieve isotopen.

|
|
Biologen isoleerden DNA uit duizend jaar oude moa-botten FOTO MORTEN ALLENTOFT |
Een internationaal team van paleogenetici onderzocht hoeveel DNA ze nog uit botten van moa's, een uitgestorven loopvogelsoort uit Nieuw-Zeeland, konden isoleren. De botten waren 7.900 tot 664 jaar oud en waren allemaal binnen een afstand van 5 kilometer van elkaar gevonden.
De halfwaardetijd van DNA in de fossiele moa-botten bleek 521 jaar. Omdat DNA-verval sneller verloopt als het warmer is, pasten de onderzoekers hun berekeningen aan om de halfwaardetijd bij hogere en lagere temperaturen te schatten. Bij een temperatuur van 25, 15, 5 en -5 graden Celsius was de gemiddelde lengte van een DNA-fragment na 10.000 jaar respectievelijk 2, 13, 88 en 633 baseparen.
De auteurs noem het daarom 'zeer onwaarschijnlijk' dat uit 85 miljoen jaar oude dinobotten DNA-fragmenten van 174 baseparen kunnen worden geisoleerd, zoals in de jaren 90 een aantal malen is geclaimd. Waarschijnlijk waren de botmonsters destijds vervuild met hedendaags DNA.
Dino-DNA is misschien buiten bereik, maar de onderzoekers bekijken hun resultaten liever van de positieve kant. Het oudste DNA dat tot nu toe is geÔsoleerd is 6oo.ooo jaar oud. Dat was DNA uit planten die diep in het ijs van Groenland lagen opgeslagen. Gezien hun resultaten denken de auteurs dat het mogelijk moet zijn om DNA te vinden dat minstens ťťn miljoen jaar oud is.
Biologieles: zelf aan de schepping knutselen
Scholieren doe DNA-proefjes met bacteriŽn
Lucas Brouwers in NRC 4 feb. 2011, p. Wet. 4.
In Frankrijk is ophef ontstaan over genetische manipulatie op school. In Nederland doen scholieren zulke proefjes ook in de klas - zelfs op een christelijke school.
Het Christelijk College Nassauw-Veluwe in Harderwijk is een van de zes scholen in Nederland waar proefjes
met genetische modificatie worden gedaan. Biologieleraar Hans Nijman kweekt een dag van te voren bacteriŽn op.
Zijn leerlingen moeten er tijdens de les een vloeistofbij druppelen, waarin speciale
ringetjes DNA zijn opgelost. De leerlingen verhitten de glazen kolfjes met bacteriŽn en koelen ze
weer af. Met een beetje geluk nemen de bacteriŽn door de heftige temperatuurwisseling de DNA-ringetjes op.
Daar zit een gen in van de Noord-Amerikaanse kristalkwal Aequoria victoria, dat een
fluorescerend eiwit produceert.
Als de leerlingen geen fouten hebben gemaakt, lichten de bacteriŽn na een paar dagen gifgroen op onder een UV-lamp.

|
De kristalkwal Aequoria victoria. Scholieren gebruiken er een gen van om bacteriŽn tijdens biologieles lichtgevend te maken. Foto Natura |
Nee, er is nooit discussie geweest of zulke experimenten wel in overeenstemming zijn met de christelijke grondslag van de school, zegt Nijman. Hij vindt het zeker geen rommelen aan de schepping: "Juist door ermee te werken, leer je begrijpen hoe die in elkaar zit."
Genetische manipulatie in de klas is lang niet overal geaccepteerd. In Frankrijk ontstond ophef
over de vraag of middelbare scholieren bacteriŽn genetisch mogen modificeren, berichtte de nieuwssite
van het wetenschappelijke tijdschrift Nature begin deze week.
Franse examenkandidaten doen al jaren proefjes waarbij ze bacteriŽn genetisch manipuleren. Maar nu
dit jaar ook 15- en 16-jarigen deze practica op school doen, roept CRIIGEN, een Franse lobbyorganisatie
voor strengere controles op genetische manipulatie, het Franse ministerie van onderwijs op om
zulke practica met genetisch gemodificeerde organismen (ggo's) voorlopig te verbieden.
CRIIGEN waarschuwt dat jonge leerlingen zich niet bewust zijn van de gevaren van het werken met ggo's voor natuur en milieu. CRIIGEN is bang dat de bacteriŽn uit het klaslokaal ontsnappen en antibioticaresistentie verspreiden in de natuur.
Maar de gekweekte bacteriŽn die in de klas worden gebruikt, kunnen buiten een laboratorium
niet overleven. Daar zijn ze te 'tam' voor: ze zouden niet eens hun eigen voedsel kunnen vinden.
In informatiemateriaal voor middelbare scholen die willen werken met genetische modificatie,
schrijft het Nederlandse ministerie van Infrastructuur en Milieu dan ook dat dit soort experimenten
'geen of een verwaarloosbaar klein risico voor mens en milieu opleveren'.
Serge Lacassie, voorzitter van de Franse vereniging voor biologie- en aardrijkskundeleraren benadrukt
dat de scholieren alle nodige veiligheidsmaatregelen leren om te voorkomen dat gemodificeerde bacteriŽn
in het milieu terecht komen. Na afloop van de proefjes worden alle bacteriŽn vernietigd. Net als in Nederland.
Voor de practica is een vergunning vereist en de scholen moeten er ook een geschikte ruimte voor
hebben - wat dat betreft moeten ze aan dezelfde eisen voldoen als onderzoeksinstellingen.
Biologieleraar Hans Nijman vindt het belangrijk dat zijn leerlingen ermee experimenteren. "Met deze
pracrica proberen wij de angst die vaak bestaat voor genetische modificatie weg te nemen", zegt hij. "Vaak
komt die angst voort uit onwetendheid. Door leerlingen te laten experimenteren met genetische
modificatie leren ze wat ermee mogelijk is en wat onzin is."
Sommige van Nijmans leerlingen creŽren voor hun profielwerkstukken zelfs lichtgevende planten of
vlinders. Ook die worden na afloop van het experiment vernietigd. Zo staat het in de wet.
Oogsttijd voor genenzoekers
In het genenonderzoek naderen de klassieke genetica en de epidemiologie elkaar.
Met vruchtbaar resultaat.
Wim KŲhler in NRC 13 feb. 2010, p. Wet. 8-9.
WIJ PLUKKEN nu eerst het laaghangend fruit," zegt genenzoeker Joris Veltman op maandag in Nijmegen. Een dag later, in Rotterdam, zegt zijn collega Andrť Uitterlinden: "De afgelopen twee jaar hebben we vooral het laaghangend fruit geplukt." En beiden zeggen: de komende jaren hangt er nog genoeg.
Het fruit, in deze beeldspraak, zijn genen waarin mutaties of varianten ziekten veroorzaken. Of de kans op ziekte verhogen, of de kans op een langer leven, of op een lang lichaam. Alle kwalen en eigenschappen die de mens kent, en waar genen invloed op hebben, zijn op het ogenblik onderdeel van de jacht naar genmutaties en genvarianten.
Daarbij lopen onderzoekers tegen grenzen aan die twee jaar geleden
nog niet werden vermoed. Het humane genoom, de in DNA-moleculen
vastgelegde erfelijke informatie, biedt steeds nieuwe verrassingen. En
inzichten. Het eenvoudige concept van 'ťťn gen, ťťn ziekte' -waarop
decennialang het succes van de genetica was gebouwd- wankelt bijvoorbeeld.
Vroeger, aan het eind van de vorige eeuw, was een genetische ziekte een
kwaal die ontstond door een mutatie in ťťn gen. Die mutatie erfde dominant
of recessief over. Dat zijn de Mendeliaanse ziekten, genoemd naar
Augustijner monnik Gregor Mendel die de wetten van de overerving in
1865 opstelde.
Daarnaast, dankzij de grootschalige projecten waarbij DNA-volgorden van hele organismen worden bepaald, is het afgelopen decennium duidelijk geworden dat op veel plaatsen in het DNA basenparen vaak variŽren. Dat zijn SNP's(zie hieronder). SNPS hebben zeker invloed op eigenschappen, op gedrag en op veelvoorkomende ziekten bij de mens: hartziekten, ouderdomdiabetes, botontkalking en kanker. Die ziekten zijn vaak multifactorieel: zowel leefstijl als verschillende genen hebben invloed.
Het nieuwe inzicht is dat de grens tussen SNPS en ziekmakende mutaties vervaagt. Niet iedere ziekmakende mutatie maakt ziek; en er zijn zeldzame SNPS met grote gevolgen.
NIEUWKOMERS
Ondertussen is het oogsttijd voor genenzoekers. De komende jaren zullen er veel genen
worden gevonden met invloed op een ziekte of kenmerk, hoe klein die invloed ook is. Veelmeer, verwachten de
speurders, dan er nu al bekend zijn. De Ónvloed van die nieuwkomers is
misschien kleiner, ze zullen wel nieuwe moleculaire mechanismen aan het
licht brengen die mogelijkheden bieden voor medicijnontwikkeling en
therapie.
Twee verschillende genzoekmethoden die nu nog hemelsbreed verschillen, naderen elkaar en zullen over vijf jaar samenvallen. De ene aanpak is die vanuit de klassieke humane genetica. De andere is die vanuit de epidemiologie met zijn grote bevolkingsonderzoeken.
Genetici in Nijmegen doen het kleinschalig: ze vinden ziekmakende genen die soms al generaties lang families teisteren. Maar hun methode is grootschalig. Ze bepalen de basenvolgorde van genen in DNA-fragmenten van tientallen miljoenen basenparen lengte. Om daaruit vervolgens ťťn veranderd basenpaar als de boosdoener aan te wijzen.
Afgelopen donderdag vierde de Nijmeegse onderzoeksgroep van de DNA-specialist Joris Veltman en hoogleraar ooggenetica Frans Cremers een feestje. Het American Journal of Human Genetics zette die dag hun vondst van een mutatie in het TSPAN12-gen online. Die mutatie, veroorzaakt de oogziekte FEVR (familiale exudatieve vitreoretinopathie, een aandoening van het netvlies). Bijzonder aan die vondst is de gebruikte methode: next generation sequencing (zie hieronder).
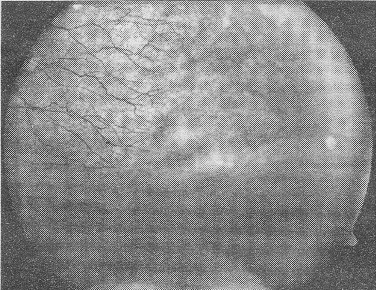 |
| Netvlies van een FEVR patiŽnt: Links zijn normale bloedvaatjes gegroeid. Rechts ontbreken ze. FOTO UMC ST RADBOUD |
In Rotterdam is de aanpak veel breder. Samenwerkend in internationale consortia zijn er binnen twee jaar tientallen nieuwe genlocaties gevonden. Door tientallen onderzoekers, gecoŲrdineerd vanuit de afdeling epidemiologie van het Erasmus MC.
OMMOORD
Aan de basis staan 15.000 inwoners (45-plussers) van de Rotterdamse wijk Ommoord waarvan er
veel al 20 jaar meedoen aan het ERGO-bevolkingsonderzoek naar verouderingsziekten. Ruim twee jaar geleden
is hun DNA gekarakteriseerd. Die gegevens genereren een aanhoudende
stroom artikelen in de beste wetenschappelijke tijdschriften.
"Ik ga het in mijn leven niet meer meemaken," zegt Bert Hofman, ERGo-directeur en hoogleraar epidemiologie in het Erasmus MC, "dat we in anderhalf tot twee jaar tijd 16 artikelen hebben in Science, Nature en Nature Genetics. En ook nog 12 of 13 in de New England, JAMA en The Lancet. Dat is ongelooflijk."
"De dekaan heeft ons na het eerste jaar een kratje champagne beloofd als ons tweede jaar net zo succesvol is als het eerste. We hebben nog een paar maanden te gaan, maar het ziet er naar uit dat hier op de afdeling de kurken wel van de flessen gaan," zegt Andrť Uitterlinden. Hij is hoogleraar complexe genetica, wat wil zeggen dat hij in zijn groep DNA analyseert en de gegevens verwerkt.
Het Rotterdamse onderzoek is gebaseerd op genome wide association studies (GWAS, zie hieronder). De DNA-gegevens van de 15.000 Ommoorders worden daarom vaak samengevoegd met soortgelijke bestanden van Amerikaanse deelnemers aan grote bevolkingsonderzoeken. Zo ontstaan bestanden met de gegevens van meer dan 100.000 mensen, om de statistische kracht te vergroten.
In Nijmegen hadden ze eigenlijk genoeg aan ťťn patiŽnt. Het was een patiŽnt met de oogziekte FEVR. Mensen met FEVR hebben een gestoorde aanleg van bloedvaten in het netvlies. De groei stokt en waar dat gebeurt kan zich vocht ophopen onder het netvlies. Daardoor kan het netvlies loslaten, en dat veroorzaakt soms ernstige slechtziendheid of zelfs blindheid.
Klassiek genetisch-diagnostisch onderzoek bij twee families waarin de oogziekte voorkomt had opgeleverd dat de gezochte genmutatie in een groot stuk DNA van 40 miljoen baseparen lang moest liggen. Maar verder waren de Nijmeegse onderzoekers met de traditionele aanpak niet gekomen. Het gebied was te groot, de speurtocht te arbeidsintensief.
Next-generation sequencing bood de oplossing. De Nijmeegse genetici strijken deze week met de eer de eerste Europese onderzoeksgroep te zijn die met de techniek een ziektegen vond.
ELF FAMILIES
Voor de oogziekte FEVR waar nu met sequencen TSPAN12-mutaties als veroorzakers zijn ontdekt,
waren al eerder drie ziekteveroorzakende genen bekend. "Maar we hadden in de afgelopen jaren elf families
verzameld," zegt Cremers, "waarin de ziekte niet door mutaties in die
drie bekende genen werd veroorzaakt. Nadat we de mutatie in ťťn patiŽnt hadden gevonden hebben we
snel gekeken of die mutatie ook in andere patiŽnten aanwezig was. Uiteindelijk vonden we hem in vijf van die
elf families." Er zijn dus nog meer genen die FEVR kunnen veroorzaken.
Gegevens van families met zeldzame ziekten worden tegenwoordig vanuit heel Europa in gespecialiseerde genetische centra verzameld, maar de mutatie in TSPAN12 die FEVR veroorzaakt stamt toch weer uit de regio. Waarschijnlijk woonde een verre voorouder van de getroffen families in Doesburg, een stadje aan de IJssel, niet ver van Nijmegen.
Maar wat heeft de patiŽnt aan die kennis? Is hij te genezen?
Cremers: "Een therapie voor FEVR is ook met de nieuwe genetische kennis
nog niet voorhanden, maar iemand met een ziekmakende mutatie voor
FEVR kan regelmatig de oogarts laten controleren of het netvlies los laat.
Die kan netvliesloslating in de kiem smoren en zo blindheid voorkomen."
Veltman: "In het algemeen willen families weten wat de oorzaak is van de
ziekte in hun familie. Bij beslissingen over kinderen ktijgen is het belangrijk om te weten of de ziekte erfelijk
is. Mensen hebben ook vaak een schuldgevoel: heb ik een ziek kind,
omdat ik tijdens de zwangerschap heb gerookt? Er is ook een kostenaspect, want mensen die het niet weten
lopen soms jaren de ziekenhuizen plat op zoek naar een diagnose. En je
kunt op grond van de gevonden mutatie vaak wel een uitspraak doen over
de prognose."
Cremers: "In de oogheelkunde speelt die vaak een belangrijke rol. Veel oogziekten geven in de loop van het leven een verslechtering. Dan is de mutatie van belang voor de studie- en beroepskeuze. Het is heel anders als je op je twintigste al blind dreigt te worden, of op je vijftigste."
Op dat individuele niveau werken de ERGO-onderzoekers in Rotterdam niet. De aanpak om bij veel mensen naar veel voorkomende varianten van veelvoorkomende ziekten te zoeken is ook heel anders dan de ziekmakende genen die genetici in patiŽnten en hun families vonden. Toch vinden die twee gebieden elkaar de komende jaren rond de DNA-sequencers. Uiteindelijk zoeken ze hetzelfde.
SEQUENCEN
Joris Veltman in Nijmegen: "Wij zochten monogene Mendeliaanse aandoeningen. Maar je moet
niet vergeten dat veel genen die uit een GWAS rollen ook een monogene component bebben. Aan de andere
kant komen GWAS-onderzoekers wat terug van het idee dat je met veelvoorkomende varianten de hele genetica
van veelvoorkomende ziekte kunt verklaren, want er zit veel meer in het
genoom. En je zult moeten sequencen om dat te vinden. Wij vinden allemaal zeldzame afwijkinkjes. Iedere
patiŽnt heeft iets anders."
Op een gegeven moment is de vraag: is zo'n hele zeldzame variant nog belangrijk? Ja, zeggen de DNA-specialis-
ten volmondig. Uitterlinden, vanuit de GWAS-wereld: "Het is duidelijk dat GWAS niet de hele genetische
achtergrond van al die aandoeningen bloot kan leggen. We vermoeden dat een
deel van de nog onbekende genetische invloed zit in variaties die bij -zeg- minder dan 1 procent van de
bevolking voorkomen, maar die waarschijnlijk grotere effecten hebben.
Dan kom je in een grijs overgangsgebied met de monogene ziekten. Die
zeldzame varianten gaan we tackelen met het sequencen. De eerste sequencers waarmee we DNA van
ERGO-deelnemers gaan sequencen artiveren deze maand in ons lab." Uitterlinden
noemt het de speurtocht naar de dark matter in het genoom.
 |
| Machines die DNA-volgorden bepalen doen dit bij DNA-fragmenten die tientallen
'letters' lang zijn. Ze zijn ontstaan door enzymatisch knippen van lange DNA-moleculen.
Door op verschillende plaatsen te knippen ontstaan miljoenen overlappende
fragmenten die in de computer op het standaard humaan genoom worden gepast (onderrand illustratie). Een belangrijk verschil, zoals hier een C-T-variant, komt op het computerscherm. ILLUSTRATIE UMC ST RADBOUD |
SNPS, SNP-ARRAYS EN GENOOMBREDE ASSOCIATIEONDERZOEKEN
SNPS zijn single nucleotide polymorphisms. Het zijn plaatsen in het DNA waar ťťn base (ťťn van de letters A, T, C of G) bij de ene mens vaak anders is als bij iemand anders. Bij 10 procent van de mensen staat er bijvoorbeeld een A, bij 90 procent een T, op een bepaalde positie in de volgorde van tweemaal 3 miljard letters die bij iedere mens de erfelijke informatie vormt. SNPS zijn belangrijk omdat ze de kans op ziekten beÔnvloeden, en de kans datje een hartziekte krijgt als je te dik bent, of diabetes.
Er bestaan miljoenen van die SNPS. Vuistregel is dat ťťn op de driehonderd posities in het menselijk genoom een SNP is. Maar misschien verandert dat nog wel in ťťn op de honderd, want dagelijks worden nieuwe SNPS toegevoegd aan voor onderzoekers toegankelijke SNP-datasets.
Dat komt doordat er steeds meer DNA-sequencers van de next generation aan het werk zijn. Dat zijn apparaten die overnacht, in ťťn geautomatiseerde run de volgorde van de basen in DNA-fragmenten van 50 miljoen basenparen bepalen. De apparaten die 500 miljoen basenparen in ťťn run doen worden nu de labs binnengereden. Volgend jaar volgen de apparaten van 5 miljard basenparen. Die bepalen in een etmaal het hele genoom van een mens. Al die volgorden worden vergeleken met het 'standaard humane genoom', dat begin deze eeuw is vastgesteld. En bestendige varianten worden aangemeld en geregistreerd als nieuwe SNP.
SNPS beÔnvloeden hoe iemand er uit ziet en waar hij aan lijdt. Het idee is dat ťťn SNP
niet direct ziekte veroorzaakt, maar dat toevallige combinaties van misschien wel
tien of misschien honderd SNPS wťl het risico op een ziekte flink kunnen verhogen.
Maar SNPS zijn niet alleen medebepalend voor uiterlijk, gedrag of ziekte. Een welgekozen
SNP karakteriseert ook een fragment van vaak miljoenen DNA-baseparen.
SNPS zijn bruikbaar als markers voor grote stukken DNA. Daarop is de SNP-array-analyse gebaseerd.
Firma's als Affymetrix en Illumina maken DNA-chips waarop honderdduizenden stukjes DNA zijn vastgelegd, met daarin steeds ťťn geselecteerde SNP. Op de huidige generatie SNP-array's zit ruim een half miljoen SNPS. Tegen de zomer arriveren de array's met 5 miljoen SNPS.
De SNP-array is de basis van genoombrede associatieonderzoeken (genome wide association studies ůf GWAS). Voor een GWAS zijn duizenden, liefst tienduizenden mensen nodig waarvan bekend is hoe ze leven en waar ze aan lijden. Zij moeten DNA hebben afgestaan waarvan op een SNP-array een SNP-profiel is bepaald. De rest is een kwestie van statistische analyses. De methode heeft de afgelopen drie jaar meer dan 500 genen opgeleverd die betrokken zijn bij ziekte, gedrag en lichaamskenmerken.
DNA-SEQUENCEN
Misschien volgend jaar al kunnen apparaten (DNA-sequencers) binnen een etmaal de volgorde van de basen in het DNA van ťťn mens vaststellen. En dat kost dan nog geen duizend dollar.
Ongeveer 1 procent van dat genoom bestaat uit genen. Dat zijn stukken DNA,
verdeeld over het hele genoom, maar inmiddels goed gedefinieerd, die de code voor
een eiwit bevatten. Dat coderende DNA kreeg een eigen naam: het exoom. Veel
genmutaties die er toe doen liggen in het exoom. Het bepalen van de DNA-volgorde
van hele exomen wordt dit jaar standaard in vooroplopende DNA-onderzoekslabs. De
rest van het genoom bestaat uit DNA dat voor genregulatie nodig is, een steunende
functie heeft, of functieloos is, en komt om praktische redenen later aan de beurt.
Er schuilen vast nog veel verrassingen in. Exoomanalyse en later genoomanalyse is
de techniek om uiteindelijk alle genvarianten te vinden die de genetica van
uiterlijk, gedrag, ziekte en levensduur bepalen. In Nijmegen begint geneticus Joris
Veltman dit jaar de eerste experimenten om DNA-sequencen bij de alledaagse
patiŽntendiagnostiek in te zetten.
Ondertussen hebben de genetici in Nijmegen de gegevens van veel families in hun dossierkasten waarvan bekend is dat er een erfelijke ziekte aanwezig is, terwijl het gen niet gevonden is.
Veltman over het komende jaar: "Je leert hoe je je lab moet organiseren, hoe je de machine moet runnen, hoe je met je gegevens om moet gaan, hoe de resultaten in de kliniek doorwerken." Dat genetisch lab ziet er heel anders uit dan vroeger. Veltman: "Eťn laborant op twee bio-informatici, dat is nu de ideale verdeling."
Die bioinformatici hebben als grote opdracht om van de pakweg 2.000 genvarianten
die ieder individu per miljoen baseparen heeft, er ťťn of twee te 'prioriteren' tot
kandidaten die mogelijk de gezochte ziekte verklaren. Dat gebeurt allereerst door
het resultaat van de DNA-sequencer te vergelŤiken met het standaard humane genoom
en met de groeiende SNP-database.
Veel varianten blijken dan normaal en vallen af. Uiteindelijk blijven er varianten
over in genen die interessant zijn vanwege een mogelijke rol bij de onderzochte
ziekte. En als de selectie niet lukt, zegt bioinformaticus Christian Gilissen in
Nijmegen: "moet je een stap terug, aan de knoppen draaien, andere drempelwaarden
instellen en nieuwe kandidaten zoeken."
In Rotterdam, waar ze over een paar jaar de hele genomen van de 15.000 ERGO-deelnemers willen analyseren, laat Andrť Uitterlinden een grafiek zien met een fataal kruispunt: de rekencapaciteit die de bioinformaticus nodig heeft wordt daar groter dan de computerindustrie nu kan bieden. Niet de DNA-sequencer, maar de computer wordt de beperkende factor.
Valerie Notenboom - Turbo-DNA NWT jrg. 77, sept. 2009, p. 60-66.
Klaar terwijl u wacht: een uitdraai van het complete genoom.
Tien jaar geleden kostte het nog jaren om het DNA van een mens volledig in kaart te brengen, straks
kan het binnen luttele minuten.
Hoe de vertrouwde DNA-streepjescode plaatsmaakt voor ultrasnelle lichtflitsapparaten en
hypermoderne nanomembranen.
De methodes om het DNA snel te sequencen nemen een steeds hogere vlucht. Hieronder staan er twee:
 |  |
In navolging van zulke spectaculaire ontwikkelingen verschijnen ook de eerste spectaculaire
onderzoeksresultaten. Het mysterieuze killervirus dat in Amerika plaatselijk 90 procent van
de bijenpopulaties om zeep hielp, kon bijvoorbeeld snel worden geÔdentificeerd
met behulp van de FLX (pyro-sequentietechniek).
Ook slaagde men er met de techniek in om het genoom van een 30.000 jaar oude
Neanderthaler voor 60 procent te ontrafelen.
Of neem het immense samenwerkingsproject 1000 Genomes Project, dat in 2008 van start ging. Met het project
hoopt een consortium van 27 academische laboratoria en drie grote, commerciŽle genoombedrijven gezamenlijk
duizend volledige genomen in kaart brengen van proefpersonen over de hele wereld. Doel is om de
genetische variatie tussen mensen onderling met ongekende precisie en volledigheid in kaart te brengen.
Andere onderzoekers hopen met behulp van tweede-generatie-sequencers hun eigen onderzoek verder uit te diepen, variŽrend van de genetische aanleg voor schizofrenie tot het ontrafelen van de genomica achter Alzheimer en de ziekte van Parkinson. Het lijkt erop dat we een stortvloed van onderzoeksresultaten tegemoet kunnen zien.
Het Britse bedrijf Oxford Nanopore Technologies heeft voor een heel andere manier
gekozen. De prettig bescheiden speler op de markt van het single molecule sequencing
kwam dit jaar met een verrassende publicatie in een vooraanstaand vakblad (Nature
Nanotechnology, 23 februari 2009).
Nanopore wil helemaal af van het DNA-vlechtertje van de natuur: het bedrijf probeert
het zonder polymerase-enzym.
 |
Daartoe maken de Britten gebruik van een chip met duizenden nanogaatjes, waaraan het enzym
exonuclease gelijmd zit. Dit enzym knipt DNA base voor base in stukjes, die met een
elektrische stroom door het nano-gaatje worden geleid. Terwijl de base
door het gaatje duikt, verandert de elektrische geleiding een beetje.
Die verandering is meetbaar en karakteristiek voor elke base: de lettervolgorde is dus direct
meetbaar aan de elektrische stroom die wordt gemeten (zie infographic 'NanoporiŽn', boven).
En dat allemaal zonder geklieder met polymerase, wasstappen of vooraf gemaakte DNA-strengen.
Afstappen van polymerase is bovendien aantrekkelijk omdat polymerase een kwetsbaar enzym is dat tijdens het lichtflitsjes-proces snel beschadigd raakt. De nanogaatjes-methode heeft daarvan geen last. Het kan langere stukken DNA onafgebroken lezen en is bovendien sneller, met ongeveer 50 basen per seconde per gaatje.
Wachtkamer: Met zulke stormachtige ontwikkelingen is het dan ook bepaald niet ondenkbaar dat we in de toekomst te maken krijgen met wachtkamer-genomica: de huisarts laat de assistente even een genoom uitdraaien, terwijl de patiŽnt zich uitkleedt. De gevolgen van supersnel DNA-sequencen kunnen enorm zijn. Erfelijke ziekten zouden zich gemakkelijk laten opsporen en in de kiem laten smoren. Behandelingen van kanker kunnen op de persoon worden toegespitst; muterende kankercellen direct in kaart worden gebracht. Verbanden tussen complexe syndromen en de genetische opmaak zullen voor het oprapen liggen. En, dat ook, de ethische gevolgen zullen grondig en kritisch moeten worden geanalyseerd.
En toch: het vijftien-minutengenoom is niet het eindpunt, want een mens is veel meer dan zijn genen alleen. Een genoomsequentie bevat bijvoorbeeld geen informatie over iemands leeftijd, over de status van het immuunsysteem of over eventuele virussen en parasieten die iemand met zich meedraagt.
Bovendien bevat het geen informatie over markeringen om het genoom heen. Soms krijgen de basen van het DNA
chemische vlaggetjes mee (methyl-groepjes), om een gen te markeren als belangrijk, of juist als onbelangrijk. Zo'n signaal
kan ervoor zorgen dat een gen wordt aangezet, of juist uitgeschakeld, of dat het DNA op een bepaalde
manier wordt opgevouwen.
'Epigenetica', is de verzamelnaam voor dit soort processen die plaatsvinden om de letterbak van het DNA
heen. En inmiddels is duidelijk dat dergelijke epigenetische 'fabrieksinstellingen' van het genoom
overerfbaar kunnen zijn. Een vrouw die een hongersnood heeft meegemaakt, draagt daarvan bijvoorbeeld
de epigenetische sporen op het DNA van haar eicellen.
Het gevolg is dat haar toekomstige kinderen anders zullen omgaan met hongerprikkels en stress dan zij
deed - allemaal omdat hun DNA anders staat afgesteld.
Haast alle sequencers gaan vooralsnog voorbij aan dergelijke epigenetische markeringen van DNA. Vandaar dat er inmiddels een grootschalig Human Epigenome Project van start is gegaan, met als doel meer te weten te komen over de invloed van dergelijke 'presets' van het genoom.
Een compleet nieuwe tak van sport dus. Biotechbedrijven staan al in de startblokken voor alweer een nieuwe race.
Huup Dassen - MicroRNA bestrijdt leverkanker bij muizen effectief
NRC 13 jun 2009. p. W. 13
Infectie van leverkankercellen met een klein stukje RNA legt de celdeling stil en leidt tot een snelle celdood. Onderzoekers in Baltimore en Columbus, Ohio hebben dit vastgesteld bij muizen. Bij acht van de tien behandelde dieren verdwenen de tumoren helemaal of grotendeels, terwijl de kanker bij zes van de acht onbehandelde controlemuizen binnen enkele maanden de lever bijna compleet verwoestte (Cell, 12 juni 2009).
MicroRNA's zijn stukjes RNA van pakweg 22 basen die met coderen voor een eiwit. Er bestaan
honderden verschillende. Sinds in 1998 werd ontdekt dat ze de activiteit van bepaalde genen
kunnen stilleggen, wordt veel onderzoek gedaan naar mogelijke therapeutische toepassingen
ervan. Daarbij bleek onder meer dat tumoren vaak microRNA's missen die in gezond weefsel
van het getroffen orgaan ruim voorradig zijn.
In kankercellen zijn blijkbaar genen geactiveerd die bij gezonde cellen niet tot
expressie kunnen komen. Een voorbeeld is leverkanker, bij mensen de op vier na meest
voorkomende vorm van kanker. Normale levercellen bevatten vrij veel microRNA-26a (miR-
26a), maar in kankercellen ontbreekt het.
Dat bracht de onderzoekers op het idee om het gen voor miR-26a toe te dienen aan muizen met leverkanker. In eerste instantie gebruikten ze gekweekte kankercellen. Na toevoeging van het gen viel de celdeling stil.
Het microRNA bleek twee voor de delingsactiviteit essentiŽle genen het zwijgen op te leggen. Vervolgens testten ze miR-26a in muizen waarbij een menselijk gen was ingebouwd dat een agressieve vorm van leverkanker veroorzaakt. Om het microRNA-gen op de juiste plaats te krijgen gebruikten ze een onschadelijk virus dat zodanig was gemanipuleerd dat het alleen levercellen infecteert.
Toen de dieren elf weken oud waren, de tumorgroei is dan doorgaans goed op gang gekomen, kregen ze het virus met het miR-26a-gen erin ingespoten. Drie weken later waren de tumoren bij acht van de tien dieren veel kleiner of zelfs verdwenen.
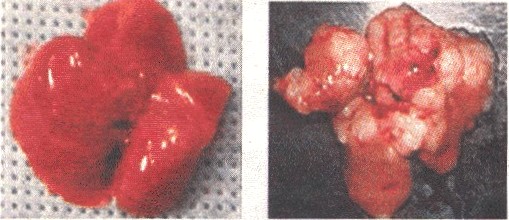 |
| Gezonde muizenlever (links) en muizenlever met tumoren (rechts). |
Niet alleen de delingsactiviteit was gestopt, de kankercellen waren ook in apoptose (geprogrammeerde celdood) gegaan, het gebruikelijke lot van ernstig beschadigde cellen. De twee 'mislukkingen' lagen niet aan het microRNA, maar kwamen doordat het virus de lever niet was binnengedrongen.
Blijkbaar is het mogelijk om gevorderde kankers op deze manier te behandelen. De onderzoekers zien
deze resultaten vooral als bewijs dat deze behandelstrategie in principe bruikbaar is. En niet alleen bij
leverkanker. Talloze andere tumoren hebben afwijkingen in hun microRNA's vergeleken met
normaal weefsel.
Huup Dassen
Andrew Fire - Hoe cellen kiezen tussen eigen en vreemd
Hans van Maanen (2004). Volkskrant 20 okt 2004. p.3W.
RNA-interferentie is een hot topic in de moleculaire biologie: er is een
nieuw venster op onze genen geopend. Andrew Fire krijgt er de Heinekenprijs voor.
Door HANS VAN MAANEN.
Wiskunde, zoveel was Andrew Fire halverwege zijn studie wel duidelijk geworden, was niets voor hem - te weinig aanspraak. De vraag was vooral, naar welk vak hij wilde overstappen. Geologie was interessant, maar paste niet helemaal in het rooster, en voor immunologie, veruit het interessantste vak, was biochemie nodig. Het werd dus biochemie. 'Daar gebeurde toen al heel veel, eind jaren zeventig, en de literatuur was toch nog goed te overzien.'
En over gebrek aan aanspraak heeft Fire ook niet meer te klagen. Deze week was hij in Nederland om de Heinekenprijs voor biochemie en biofysica in ontvangst te nemen, voor zijn 'ontdekking van de RNA-interferentie'.
Hoe legt hij een willekeurige voorbijganger uit waarvoor hij een prijs krijgt?
'RNA-interferentie is een verdedigingsmechanisme van de cel, het is een manier om
'eigen' van 'vreemd' te onderscheiden en om snel in te kunnen grijpen als er ergens,
binnen of buiten de cel, iets lijkt mis te gaan. Door RNA-interferentie wordt de
productie van ongewenste eiwitten stilgelegd.'
Enige voorkennis is dus noodzakelijk. Vanouds vergelijkt men een cel graag met een fabriek. De bouwinstructies voor allerlei verschillende stoffen liggen, in de vorm van DNA-strengen, veilig opgeborgen in de celkern. Het DNA bemoeit zich verder nergens mee: het RNA haalt zijn instructies, gen voor gen, op van het DNA en zorgt in de cel voor de productie van de gewenste eiwitten - in de maag maagsap, in de galwegen gal, enzovoort. Door een cel krioelen dus talloze losse strengen RNA die de aanmaak van de verschillende stoffen regisseren.
Het probleem zijn de indringers. Virussen bijvoorbeeld: die proberen de machinerie van de cel over te nemen door hun eigen RNA in te spuiten, en de cel zo te dwingen tot het aanmaken van virusonderdelen in plaats van gal of maagsap. Daartegen moet de cel zich wapenen, en dat doet het door RNA-interferentie.
Het virus zal, als het de boel wil overnemen, kopieŽn van zichzelf, dus van zijn eigen RNA moeten laten maken. Het moet, net als het DNA in de celkern, door RNA worden 'afgelezen': er wordt een negatieve kopie gemaakt - biologen spreken van sense en antisense; een gewone streng RNA is sense, een negatieve kopie is antisense. Op het moment dat het virus-RNA wordt afgelezen, is het dus onvermijdelijk even verdubbeld - biologen spreken van dubbelstrengs-RNA. En op dat moment merkt de cel dat er iets niet pluis is (er zijn ook virussen die van zichzelf al dubbelstrengs zijn, maar die hebben uiteraard meteen een probleem).
Zodra de cel ergens een stuk dubbelstrengs-RNA tegenkomt, weet ze dat er een vijandelijke overname aan de gang is, en de productie van alle stoffen waarvoor dit RNA de opdracht geeft, wordt stilgelegd. Eventueel worden zelfs alle al volgens die RNA-voorschriften gefabriceerde stoffen weer afgebroken om te zorgen dat er geen verdere virusonderdelen meer geassembleerd kunnen worden.
'Zo klinkt het heel logisch allemaal,' zegt Fire er meteen bij, 'maar het was oorspronkelijk een puur chemisch probleem, dat van een heel andere kant benaderd werd. Mijn bijdrage was dus eigenlijk heel bescheiden, het begrip van wat er precies aan de hand was, kwam van anderen.'
Die andere kant was niet het probleem van de cel, maar van onderzoekers: hoe kunnen genen (dus bouwinstructies) effectief worden stilgelegd. Dat zou immers in het laboratorium erg goed van pas komen: door een gen onklaar te maken, zou men kunnen uitzoeken waarvoor dat gen precies diende en wat er met een levend wezen zou gebeuren als dat gen was uitgeschakeld en de bijbehorende stof niet werd aangemaakt.
Fire: 'Het was al duidelijk dat het inbrengen van RNA in een cel de boel flink kon verstoren. Het eerste idee was natuurlijk om RNA in te brengen dat het RNA in de cel zou afplakken, dus antisense-RNA. Dat werkte wel, maar niet heel goed. Bovendien bleek dat sense-RNA ook af en toe een beetje werkte. Het was allemaal vrij raadselachtig, en er waren voortdurend conferenties om het probleem te bespreken.
'Men was er, rond 1997, van overtuigd dat het probleem in de vervuiling zat - een stof is nooit helemaal zuiver te maken, en de gedachte was dat bij het maken van dat sense- of antisense-RNA er allerlei ongewenste stoffen meekwamen.
'Het was na een praatje van Craig Mello, weet ik nog wel, dat ik bedacht om ook eens naar dubbelstrengs-RNA te kijken. Als je sense- of antisense-RNA maakt, maak je ook dubbelstrengs-RNA: misschien was dat waar het om ging. Het was niet een soort Aha-Erlebnis, hoor - dat denken mensen al gauw, dat je opeens een licht opgaat - maar het was gewoon een proefje dat ik op mijn lijstje zette, iets om eens uit te zoeken.'
Dat proefje betekende echter wel de doorbraak. Niet sense-, niet antisense-, maar dubbelstrengs-RNA legt buitengewoon efficiŽnt de productie in de cel stil, zo toonde hij samen met onder anderen Craig Mello in een inmiddels befaamd artikel in Nature aan.
De verklaring van het mechanisme van de RNA-interferentie kwam pas later, maar het was iedereen onmiddellijk duidelijk dat hiermee een nieuw instrument was gesmeed om de werking van genen te bestuderen. Maak een RNA-kopie van het DNA waarin je geÔnteresseerd bent, maak het dubbelstrengs, en spuit het in de cel. De cel zelf doet, via RNA-interferentie, de rest. Zeker met de stortvloed aan nieuwe, onbekende genen uit het menselijkgenoomproject die nog in kaart gebracht moeten worden, was dit buitengewoon welkom - en zeker een Heinekenprijs waard.
'Op de wat langere termijn,' zegt Fire, 'leren we er ongetwijfeld beter van hoe een cel in elkaar zit, hoe een cel probeert een evenwicht te vinden tussen stabiliteit en verandering. Als er wat misgaat, moet er worden ingegrepen, als er iets in de omgeving verandert, moet hij meeveranderen. Maar ik denk bijvoorbeeld dat we ook beter gaan begrijpen hoe allerlei ziekten ontstaan, en hoe een cel zich daartegen teweerstelt. Bij kanker bijvoorbeeld worden tumorgenen soms stilgelegd, en het zou interessant zijn om te weten hoe zoiets gaat.'
Voor nieuwe geneesmiddelen, de onvermijdelijke volgende vraag, vindt Fire het nog veel te vroeg. 'Het gebeurt nu nog bijna allemaal in de reageerbuis, het is nog onduidelijk hoe je dat dubbelstrengs-RNA in een levend wezen moet brengen. Hoewel - er zijn al experimenten met proefdieren gedaan, en ik geloof dat er binnenkort ook proeven beginnen om op deze manier bij mensen een oogziekte, maculadegeneratie, te verhelpen. En men denkt ook aan hepatitis-C, hoorde ik laatst. Maar voorlopig is het toch vooral wetenschappelijk interessant - er valt nog zoveel uit te zoeken.'
En aan aanspraak, om daar nog even op terug te komen, heeft hij inderdaad geen gebrek. Na het in ontvangst nemen van de Heineken-prijs - 'Ik ben nog nooit zo ver van huis geweest' - vliegt Fire direct weer terug naar zijn universiteit, naar Stanford.
Dat is allang niet meer het middelpunt van het onderzoek naar RNA-interferentie, daarvoor gaan de ontwikkelingen veel te snel, maar Fire zit nog wel in de voorhoede. 'Eigenlijk ben ik nu de hele dag aan het praten,' zegt hij. 'We overleggen over nieuwe experimenten, we proberen de zaken beter te begrijpen, bedenken nieuwe theorieŽn. Als ik nog twee uur in het laboratorium sta, is het veel.'
Huub Dassen (2004). NRC 17 juli 2004 p. 18
Muizen met een erfelijke ziekte die de coŲrdinatie van hun bewegingen aantast en tot spasticiteit leidt, knappen op na toepassing van RNA interferentie. Met deze nieuwe vorm van gentherapie kunnen gemuteerde genen geen foute eiwitten meer produceren. Erfelijke afwijkingen kunnen dan niet meer tot uiting komen. Deze uitkomst van Amerikaans onderzoek geleid door Beverly Davidson (University of Iowa) is mogelijk ook van toepassing bij andere erfelijke en ongeneeslijke neurologische aandoeningen, zoals de ziekte van Huntington (Nature Medicine online, 4 juli 2004).
De muizen hadden spinocerebellaire ataxie type 1 (SCA1): een zeldzame erfelijke ziekte van het zenuwstelsel die bij mensen gewoonlijk tussen het 30ste en 40ste levensjaar toeslaat. De patiŽnt krijgt problemen met de coŲrdinatie van bewegingen (ataxie) en/of spraakproblemen. Deze worden geleidelijk ernstiger en leiden binnen een jaar of tien tot invaliditeit.
De symptomen ontstaan als gevolg van degeneratie van zenuwcellen in het ruggenmerg (spina, ae f.), de hersenstam en de kleine hersenen (cerebellum). Er bestaan ongeveer 20 verschillende typen SCA die gemeen hebben dat de erfelijke afwijking dominant wordt overgedragen.
Men hoeft maar ťťn gemuteerd exemplaar van het gen voor het eiwit ataxine-l te hebben om de ziekte te krijgen. De mutaties bij de verschillende vormen van SCA maken dat het eiwit abnormale hoeveelheden van het aminozuur glutamine bevat. Vermoed wordt dat dit het energiemetabolisme van de cellen aantast en/of de geprogrammeerde celdood (apoptose) ontijdig op gang brengt.
De aard van de aandoeningen maakt het logisch om een remedie te zoeken in een vorm van gentherapie. Een relatief nieuwe methode daarvoor is de toepassing van RNA interferentie (RNAi). Daarbij gebruikt men korte dubbelstrengs RNA-moleculen die zo zijn ontworpen dat zij het aflezen van een gen, in dit geval het gemuteerde gen voor ataxine-l, kunnen blokkeren. Het gezonde exemplaar van het ataxinegen blijft dan normaal functioneren.
Nadat de onderzoekers een geschikt RNAi hadden geconstrueerd brachten zij dit in bij muizen met SCA1.
Die waren niet meer in staat om in een tredmolentje te lopen, omdat zij hun voorpoten niet op de spijltjes van
de molen konden zetten. Hun ooghandcoŲrdinatie, een taak van de kleine hersenen, was duidelijk gestoord.
Het RNAi werd toegediend door het in een virus op te nemen en dat in het getroffen deel van het centrale
zenuwstelsel te spuiten.
Na twee weken speelden de muizen weer gewoon in de tredmolen. Microscopisch onderzoek van
de kleine hersenen wees uit dat allerlei morfologische afwijkingen waren genormaliseerd.
Ook bleek dat de zogeheten Purkinjecellen, die een essentiŽle rol bij de coŲrdinatie van bewegingen spelen,
weer normaal ataxine-1 bevatten.
Wim KŲhler(2002). RNAi breekt door. NRC 21 dec. p. 38.
RNA blijkt erfelijke eigenschappen te kunnen wijzigen, zonder dat er genen veranderen. En gedurende het leven kan RNA groepen van genen langdurig verhinderen om eiwit te produceren. Het vakgebied van de niet op DNA gebaseerde genetica heeft inmiddels een eigen naam: de epigenetica. Het woord epigenetica was al gemunt toen werd gedacht dat vooral methylering van DNA genen stillegt. Maar nu is de aandacht sterk gericht op RNA-moleculen die op specifieke plaatsen op de chromosomen binden en daarbij genen, of zelfs hele groepen van genen stilleggen.
RNA is de afkorting van ribonucleic acid. Het is een polymeer, bestaande uit enkele, of tienduizenden, om en om aan elkaar gekoppelde fosfaatgroepen en suikermoleculen (de ribose). Aan ieder suikermolecuul zit een base: adenine, guanine, thymine of uracil. De volgorde waarin die basen in het molecuul liggen, geeft ieder RNA-molecuul zijn unieke eigenschappen.
Wie basisonderwijs in de biochemie heeft genoten kent RNA als messenger-RNA (mRNA), als transfer-RNA (tRNA) en wellicht ook als ribosomaal RNA (rRNA). Een mRNA-molecuul is een kopie van een gen, dus van een stuk DNA.
Het mRNA brengt de genetische informatie vanuit de celkern naar de ribosomen. Die ribosomen zijn opgebouwd uit eiwit en uit RNA. Dat heet, vanwege zijn eigen structuur, ribosomaal RNA (rRNA). In de ribosomen wordt de genetische informatie gebruikt voor de synthese van eiwitten. Eiwitten bestaan uit lange ketens van (20 verschillende) aminozuren. Iedere drie opeenvolgende basen in het mRNA bepalen welk van de twintig aminozuren als volgende in een eiwitketen wordt geplaatst. En het aanvoeren en plaatsen van een aminozuur is het werk van een transfer-RNA, een mooi opgevouwen RNA-molecuul dat de code van drie basen leest en en het bijpassende aminozuur heeft gebonden.
mRNA, tRNA en rRNA, jarenlang bestond er niet meer. RNA was een soort servicemolecuul, in dienst van DNA. Vanaf de jaren veertig, toen biochemici de details van de moleculaire genetica ontrafelden, kreeg RNA de status van het saaie suffertje naast DNA. DNA bevat genen, DNA is het erfelijk materiaal dat we van onze twee ouders meekrijgen en in brokken aan eventuele kinderen doorgeven. De raadsels van het leven lagen in DNA.
Maar sinds het humane genoom is ontrafeld en sinds de volgorde van de drie miljard basenparen in het menselijk DNA in databases op internet staat, is de status van DNA in een vrije val geraakt. Er zitten maar 23.500 genen in het menselijk DNA. Het DNA is eigenlijk niet meer dan een starre, bijna lege bibliotheek. Die bovendien nog voortdurend reparatie behoeft.
De producten van DNA, de eiwitten, hebben de laatste jaren weer meer aandacht gekregen, met hun eigen vakgebied van de proteomics.
Halverwege de jaren tachtig rimpelde de toen doodstille RNA-vijver: Thomas Cech ontdekte dat RNA-moleculen ook enzymen kunnen zijn. Tot dan toe bestonden enzymen alleen uit eiwit. Enzymen zijn biomoleculen die heel specifieke bioreacties uitvoeren. Ze knippen andere eiwitten, of DNA, of RNA. Of ze bouwen eiwitten en DNA op. Het RNA-enzym dat Cech ontdekte knipt RNA in korte stukken, of maakt korte stukken weer langer.
De ontdekking van Cech gaf een nieuwe kijk op de vroegste evolutie. De nijpende vraag was daar welk molecuul er eerder was: DNA of eiwit. Het antwoord werd: RNA. RNA kan zowel bouwsteen, als enzym als opslagmedium van erfelijke informatie zijn.
Het werk van Cech veranderde ook de kijk op ribosomaal RNA (rRNA). rRNA is decennialang als passieve bouwsteen gezien. Maar inmiddels staan de rRNA's te boek als de moleculen die de eiwitsynthese op de ribosomen actief sturen.
Het mooie van RNA is dat het, in tegenstelling tot DNA, enkelstrengs is. DNA is dubbelstrengs: iedere base in DNA is gepaard met zijn complementaire base in een tweede DNA-streng. Maar de basen van RNA zijn ongepaard, totdat het molecuul op zichzelf terugvouwt. De basen van ťťn streng binden dan aan basen uit dezelfde streng die een stuk verderop liggen. Er ontstaan dan stabiele driedimensionale structuren: haarspelden, boomstructuren, pseudoknopen, en in tRNA zelfs stukken helix. RNA bestaat doorgaans uit deels gepaarde en deels ongepaarde basen.
mRNA, tRNA en rRNA, de RNA's die tot nu toe bekend waren, zijn allemaal forse moleculen. mRNA en rRNA bevatten doorgaans minstens honderden basen, terwijl tRNA altijd nog tussen de 70 en 100 basen groot is.
De RNA-moleculen die de Science-redactie tot doorbraak van het jaar heeft uitgeroepen zijn veel kleiner. Vaak tellen RNAi's maar 10 tot 30 basenparen. Ze hebben andere functies. Ze binden specifiek aan DNA of aan eiwit en blokkeren cruciale functies: de celdeling, het aflezen van een enkel gen of van hele groepen genen. De nieuwe RNA's hebben al geleid tot een nieuwe kleine letter, die achter RNA staat: RNAi (RNA interference). RNAi wordt inmiddels gebruikt om therapieŽn te ontwikkelen en er zijn bestaande ziekten (zoals waarschijnlijk het fragiele-X-syndroom, na het Downsyndroom de belangrijkste oorzaak van zwakzinnigheid) die ontstaan door verstoringen in de genregulering door RNAi's.
LICHTSCHAKELAAR ACTIVEERT DE GENEN NAAR BELIEVEN
Om de functie van genen in verschillende stadia van ontwikkeling te kunnen bepalen is het handig ze naar believen aan of uit te kunnen zetten. Dankzij het werk van Amerikaanse onderzoekers kan dat nu heel gemakkelijk door cellen met verschillende kleuren licht te beschijnen (Nature Biotechnology, sept).
Peter Quail en zijn collega's van de universiteit van Berkeley en het Amerikaanse ministerie van landbouw gingen uit van de eigenschappen van het eiwit fytochroom, dat in veel planten zorgt voor de absorptie van zonlicht. Het heeft twee verschillende verschijningsvormen die in elkaar over kunnen gaan: in rood licht heeft het een zodanige structuur dat het kan binden aan een ander eiwit, PIF3, door absorptie van infrarood licht wordt die binding weer verbroken, omdat het fytochroom van vorm verandert.
De onderzoekers benutten deze vormverandering. Ze namen een eiwit dat genen activeert door zich op de juiste plaats aan het DNA vast te zetten, en knipten dat in twee helften. Daardoor verliest het zijn werking; de twee helften kunnen afzonderlijk niet functioneren. De ene helft zetten ze vast aan fytochroom, de andere helft aan PIF3. Door dit geheel nu met rood licht te beschijnen, binden niet alleen het fytochroom en PIF3 zich aan elkaar, maar worden ook de twee helften van het activeringseiwit zo dicht bij elkaar gebracht dat dit zijn werking terugkrijgt. Dat werd in het experiment duidelijk doordat het een gen aanzette dat gistcellen blauw kleurt. Door de gistcellen met infrarood licht te beschijnen werd de aanmaak van de blauwe kleurstof direct gestopt.
Een gen dat met behulp van licht kan worden geschakeld heeft als grote voordeel dat het onderzoekers in staat stelt om de functie van een gen te bepalen in de verschillende stadia van de ontwikkeling van een cel. Dat is met de traditionele knock-out methoden, met behulp van warmte of chemicaliŽn, niet mogelijk. Met een gerichte straal licht kunnen bovendien de genen in een afzonderlijke cel in het weefsel worden aangepakt. ChemicaliŽn hebben nog als extra nadeel dat ze vaak giftig zijn, en een natuurlijke ontwikkeling in de weg staan.
ROB VAN DEN BERG
DNA kan niet op tegen huidskleur.
De feiten spraken voor zich, zou een normaal mens denken. Op de
avond van 12 juni 1994 werden O.J. Simpsons ex-vrouw Nicole Brown
en haar vriend Ron Goldman bij hun huis neergestoken. Op die plek
vond de politie een zeldzaam type handschoen en afdrukken van een
schoen waarvan er ooit maar twee zijn gemaakt (Bruno Magli, maat 12).
Simpson droeg zulke schoenen en ook werden die handschoenen bij
hem gevonden.
Daarnaast troffen agenten diverse bloedsporen van zowel de
slachtoffers als van Simpson aan in en rond het huis van de
ex-football-speler. Bloed en haren van Simpson werden bovendien
gevonden op de plek van de moord.
Het bewijs daarvoor kwam van twee methoden van DNA-analyse:
(Een RFLP is een verschil in restrictiefragmenten, die veroorzaakt kunnen worden door een SNP (puntmutatie), een SNP levert niet per se een RFLP op. De term "restricitieplaatsen van het DNA" is te beladen. Er is niets speciaals aan en het zijn geen specifieke plaatsen, maar restricitie-enzymen kunnen overal in het DNA knippen, afhankelijk van hun herkenningssequentie. Restrictie komt van het lat. re-stringere, restringo, restrinxi, restrictum - beperken. Het enzym is beperkt tot een vaste knipplaats, bijv. alleen daar waar de volgorde AAGC voorkomt.)
Simpsons advocatenteam liet
tijdens het proces zelfs PCR-uitvinder Kary Mullis opdraven.
Het mocht niet
baten: het DNA-profiel van de bloedsporen bij de lijken bleek met een 'foutkans' van
1 op 240 duizend volgens de STR-methodiek en van 1 op de 170
miljoen volgens de RFLP-techniek van O.J. Simpson.
Dat Simpson toch is vrijgesproken, is waarschijnlijk te wijten aan
eigenaardigheden van de Amerikanen en hun rechtssysteem. Agenten zouden de
verdachte voor "nigger" hebben uitgemaakt. Het juryproces werd een
strijd tussen blank en zwart: feiten deden er niet zo toe, politieke correctheid des
te meer.
Niet uniek.
De 'genetische vingerafdruk' is uniek, maar zo nauwkeurig zijn de gebruikte
methodes niet dat ze echt uniek zijn. Dat komt omdat er maar zeven
merkers (markers) worden gebruikt, daardoor is de kans dat je iemand anders treft met
hetzelfde profiel ongeveer 1 op de honderdduizend. Die merkers zijn short
tandem repeats (STR's, ook wel microsatellieten genoemd). Dit zijn zich
herhalende, korte stukjes DNA, bijvoorbeeld van het kwartet CTAG. Bij de
ťťn komen bijvoorbeeld vier herhalingen van CTAG voor, bij de ander
zeven. De forensisch genetici voeren een PCR-reactie uit met (gelabelde)
primers tegen DNA dat zich aan weerszijden van een STR bevindt. Daarbij
ontstaan miljoenen stukjes van hetzelfde STR; dat is vervolgens met een
electroforese-gel aan te tonen.
 |
|
SNP = Single Nucleotide Polymorphism (puntmutatie) |
Tegenwoordig gebruiken de analisten van Justitie primers voor meerdere
STR's, dat heet dan de multiplex-methode. In Rijswijk gebruikt men een
staande gel. Dat levert geen standaard gel-bandjespatroon op, maar een
grafiek met meerdere pieken. De DNA-fragmenten lopen onderaan uit de gel
waar ze worden afgelezen. De bandjes zijn dan als een piek te zien, met op
de x-as de lengte in baseparen en op de y-as de concentratie van het DNA-
fragment. Overigens heeft ieder individu twee bandjes van elk STR - op elk
chromosoom ťťn.
Stel een DNA-profiel bestaat uit vier STR-merkers. Wanneer nu de kans op
voorkomen van een bepaalde STR-lengte in een populatie telkens tien
procent is, is de kans op voorkomen (of frequentie) van een DNA-profiel
0,1 * 0,1 * 0,1 * 0,1 = 0,0001 (ťťn op de tienduizend). Met de zeven
merkers die het Rijswijkse lab gebruikt, geldt een frequentie van ongeveer
ťťn op de honderdduizend.
Vaak heeft ieder land zijn eigen set met merkers. Bij grensoverschrijdend
politie-onderzoek is dat uiterst onhandig; vergelijken is niet mogelijk. En
omdat na het politie-onderzoek het biologisch materiaal (eigenlijk) vernietigd
moet worden, lukt het vaak niet meer om nieuwe profielen te maken.
Een West-Europese werkgroep is nu druk doende een standaardset te
ontwikkelen. Haast is geboden, want bij eventuele overschakeling op andere
merkers is vergelijken met oude profielen niet meer mogelijk. Nederland
heeft nu dezelfde merkers als de Engelsen (en die lopen voorop met forensisch
DNA-onderzoek) en deels dezelfde merkers als Duitsland en Frankrijk.
Coderend DNA?
De Rijswijkse STR's heten VWA, THO of Amelogenin. Ze komen voor in
het niet-coderend DNA (junk-DNA): dat varieert veel meer dan het coderende deel van
het erfelijk materiaal. Hoe groter de variatie, hoe kleiner de
kans op vals-positieven. Overigens mag het Gerechtelijk Laboratorium
volgens de wet niet werken aan coderend DNA - om eventueel misbruik van
erfelijke gegevens zoveel mogelijk te voorkomen.
Toch zou coderend DNA de politie zeer nuttige informatie kunnen leveren.
Waarschijnlijk is het erg omstreden, maar met het erfelijk materiaal kunnen
genetici op termijn uiterlijke kenmerken bepalen. Denk aan het geslacht, ras,
de kleur van het haar, de ogen of de huid. Voorlopig is het toekomstmuziek:
met haar- en oogkleur zal het vast wel lukken, maar niet met kenmerken als
lengte en postuur. Die hangen van vele genen en het milieu af.
Voorlopig zal men geen nieuwe technieken in het Rijswijkse huis halen.
Analyses met DNA-chips of van mitochondriaal DNA zijn te duur. Van
mitochondriaal DNA is vaak meer beschikbaar dan DNA uit de kern en in
haren is het kern DNA vaak afgebroken. Het grootste nadeel is echter het
volgende: als je overstapt op een nieuwe methode, kun je niet meer
vergelijken met de oude bestanden.
Gaby van Caulil in BIOnieuws 13 - 28 augustus 1999 -
jaargang 9 - pag. 5.
Gespleten genen vormen een evolutionaire blokkendoos.
Marcel aan de Brugh in Interm. 10 dec. 1993, p. 35.
Ze wisten als eersten de geheimen van de gespleten genen te ontsluieren. Maar het was een close finish. Het scheelde een haar of iemand anders was er met de ontdekking vandoor gegaan. Nobelprijswinnaars in de fysiologie, Sharp en Roberts, kwamen in de eerste week van juni 1977 met hun resultaten voor de dag. Tegelijkertijd en onafhankelijk. Het gebeurde tijdens een bijeenkomst in Cold Spring Harbor en veroorzaakte veel opschudding en enthousiasme: 'De toehoorders waren verbaasd, gefascineerd en enigszins verbijsterd', schreef het wetenschappelijke blad Nature een maand later. James Watson, mede-ontdekker van de DNA-structuur en organisator van het symposium, verklaarde later: `Veel deelnemers vertrokken met het gevoel dat ze een historisch moment hadden bijgewoond.'
MozaÔekmoleculen.
Voor het symposium dachten de moleculair-biologen dat ze het
genetisch wereldbeeld wel zo'n beetje rond hadden. Het erfelijk
materiaal (DNA) van alle organismen was een soort reusachtige
bibliotheek met duizenden boeken - de genen. Ieder boek bevat het
recept voor de aanmaak van een eiwit. Zodra er wat van dat eiwit
nodig is, wordt het boek integraal gekopieerd; de kopie, die bestaat
uit RNA, gaat als een soort boodschapper de cel door, en komt aan
bij de ribosomen, de eiwitfabriekjes van de cel, waar het recept
wordt afgelezen en uitgevoerd, zodat het gewenste eiwit ontstaat.
NŠ het symposium was duidelijk dat de zaak nog een stuk ingewikkelder
was. Het verhaal klopte voor lagere organismen, zoals bacteriŽn en
schimmels, maar bij hogere organismen was er meer aan de hand. Die
beschikken over `gespleten genen' of zoals Sharp en Roberts het in
`77 nog noemden, `mozaÔekmoleculen'.
Beide onderzoekers namen het adenovirus als proeforganisme. Deze parasiet infecteert bij voorkeur menselijke longcellen en gebruikt die om zich voort te planten. De genetica van het adenovirus vertoont nogal wat overeenkomsten met die van de mens. Het is daarom een prima 'modelsysteem' voor onderzoek naar de relatie tussen DNA, RNA en eiwitten bij hogere organismen.
Roberts en Sharp vergeleken een boek uit de adenovirusbibliotheek (een gen) met de bijbehorende RNA-kopie, de boodschapper. Tot hun stomme verbazing kwamen de twee niet overeen. Het boodschappermolecuul bleek een flink stuk korter. Na verder onderzoek bleek het opgebouwd uit vier losse stukken, die allemaal terug werden gevonden in het DNA, maar daar gespleten bleken te zijn: ze lagen een flink stuk uit elkaar. De tussenliggende stukken DNA waren niet terug te vinden op het RNA.
Volgens de onderzoekers moest dit ongeveer als volgt zijn gelopen: na het kopiŽren wordt een aantal stevige hoofdstukken uit de RNA-kopie weggeknipt. De resterende delen worden netjes aan elkaar geplakt. De zo ontstane, ingekorte kopie - en dus niet het oorspronkelijke boek - bevat de essentiŽle informatie voor de aanmaak van het eiwit. Dit idee is sindsdien door talloze experimenten bevestigd. Het knip- en plakwerk aan het RNA wordt splicing (het splitsen als van touw) genoemd.
Snellere evolutie.
Sharp en Roberts waren niks te vroeg met hun ontdekking. Al
tijdens het symposium in Cold Spring Harbor presenteerde een andere
groep (van Amerikaanse en IsraŽlische onderzoekers) resultaten van
gelijksoortig onderzoek met een ander virus. Kort daarna stuitten
diverse andere onderzoekers op het fenomeen, waaronder twee
biochemici van de Universiteit van Amsterdam, die het hadden
waargenomen bij een stuk konijnen-RNA. Ze waren twee maanden te laat.
De vraag die moleculair-biologen zich na de ontdekking van de 'gespleten genen' onmiddellijk stelden was: waarom? Wat moeten die grote, schijnbaar nutteloze fragmenten nonsens-DNA (ook wel introns genaamd) tussen de werkelijk informatieve stukken, de exons? En waarom hebben alleen hogere organismen dit? Zoiets moet toch een reden hebben.
Het meest gangbare antwoord tot nu toe luidt: splicing maakt een
snellere evolutie mogelijk. De exons op het DNA zijn als blokken
uit een blokkendoos: ze zijn op allerlei manieren aan elkaar te
leggen. Zo kunnen min of meer toevallig totaal nieuwe eiwitten
ontstaan, die waardeloos kunnen blijken, maar soms ook een heel
nuttige functie kunnen vervullen.
Neem bijvoorbeeld het sarcomeer, de bouwsteen van spiervezels. Dat
is samengesteld uit zeven eiwitten. Voor ieder eiwit zijn vijf
genen aanwezig en ieder gen bevat ongeveer dertig exons. In
totaal zijn er vele miljoenen mogelijkheden om met deze bouwstenen
een sarcomeer te bouwen. Zo nu en dan in de evolutie ontstaat per
ongeluk een nieuwe variant die beter voldoet.
Dank zij deze exon shuffling beschikken hogere organismen
over een enorme capaciteit om snel in te springen op veranderingen
in hun omgeving.
Op het nippertje.
De medaille heeft echter twee kanten. Het knippen en plakken gaat
niet altijd van een leien dakje. Er sluipen geregeld fouten in -
met als gevolg dat de kopie verkeerd ingekort wordt, waardoor de
informatie niet klopt en verkeerde eiwitten worden geproduceerd.
Bij ongeveer een kwart van de vijfduizend thans bekende erfelijke
ziekten schuilt de oorzaak in een verkeerd splicing-proces. En een
haperende splicing kan ook leiden tot kanker, zoals het geval is
bij chronische leukemie.
De ontdekking van gespleten genen bracht een revolutie in de celbiologie teweeg, zowel op fundamenteel niveau - bij het begrijpen van moleculaire processen in de cel - als in de geneeskunde, zoals bij de behandeling van erfelijke aandoeningen en kanker. De ontdekkers van dit proces verdienen dan ook de eer. Maar Sharp en Roberts hebben vooral veel geluk gehad. Zij wisten een rat race op het nippertje in hun voordeel te beslissen.