Archaea
- Rinze Benedictus (2001). Archaea blijken helemaal niet zeldzaam.
Bionieuws 20 jan. p. 8.
- Ingrid van Vilsteren (2000). Hittebestendige bacterie speelt leentjebuur.
Natuur en Techniek, november, p.13.
- Arno van 't Hoog. 1999. Deinococcus radiodurans blijkt vaardige DNA-reparateur.
Bionieuws. Jrg. 9. Nr. 19. 27 nov. p.1. k.5-6 en p.2. k.1-3. - Marcel aan de Brugh. 1999. Stralingsbestendige bacterie herstelt DNA-schade volledig.
NRC 20 nov. p.55. k.7.
- Raaij, Visser en Ramakers (2011) - Rotbacillen. De Ehec-bacterie.
Volkskrant, 11 juni, p. W.1-3. Art. zie hieronder. - Brett Finlay (2010) - De kunst van de bacteriŽle oorlogvoering.
Scientific American Nederlandstalig v. mrt-apr. nr. 28, p. 28-35. Art. zie hieronder. - Dirty game - Help bacteriŽn om zeep. Een spelletje voor 12-16 jarigen om spelenderwijs
hygiŽne bij te brengen. Het kan online gespeeld worden, maar je kunt het hele spel ook downloaden. Het is te vinden op www.voedingscentrum.nl.
- Rob van de Berg (2001). Laag van geladen moleculen doodt specifieke bacteriŽn. NRC, 16 juni, p. 48
De Ehec-bacterie heeft tientallen doden en duizenden zieken veroorzaakt. De epidiemie, die met name in Duitsland huishoudt, lijkt inmiddels over haar hoogtepunt heen. Hoeven we ons dus geen zorgen meer te maken? Microbiologen Alex Friedrich en Jan Kluytmans en geneticus Frederick Blattner maken de balans op. 'Er liggen nog tal van gevaarlijke bacteriŽn op de loer.'
Door Ben van Raaij, Ellen de Visser en Rob Ramakers in de Volkskrant van 11 juni 2011, p. W.1 - W.3.
Met vele miljarden zijn ze, de E.coli bacteriŽn in onze darmen, en ze doen er goed werk door voedsel te verteren. Dat die onschuldige darmbacteriŽn ook in ziekmakende varianten voorkomen, moet iedereen weten want dat leidt tot diarree.
Sinds drie weken is echter opeens ook duidelijk dat ze levensgevaarlijk kunnen zijn. Tientallen doden en duizenden zieken telt de regio Hamburg inmiddels door de eerste uitbraak van een zeldzame stam van de Ehec-bacterie, een E. coli met een verwoestende combinatie van agressieve kenmerken, overgenomen uit andere bacteriŽn.
 |
ťťn van de vele stammen |
Het aantal besmettingen is inmiddels vermoedelijk over zijn hoogtepunt heen, en Nederland lijkt met slechts een paar ziektegevallen de dans ontsprongen. Maar betekent dit ook dat we ons geen zorgen meer hoeven te maken?
We maken de voorlopige balans op met drie deskundigen.
- Microbioloog Alex Friedrich werkte tien jaar in het referentielaboratorium in MŁnster, waar hij zich veelvuldig met de Ehec-bacterie heeft bezig gehouden. Sinds begin dit jaar is hij hoofd van de afdeling medische microbiologie in het Groningse UMCG.
- Jan Kluytmans is hoogleraar microbiologie en infectiepreventie aan het Amsterdamse UMCG en arts-microbioloog in het Amphia ziekenhuis in Breda.
- Frederick R. Blattner, hoogleraar genetica aan de universiteit van Wisconsin, is de man achter het E.coli Genome Project van die universiteit. Hij bracht in 1997 het complete E.coli-genoom in kaart en vervolgens een aantal al dan niet ziekmakende stammen, maar ook de Shigella- (dysenterie), de salmonella- (tyfus) en de pestbacterie.
Wat voor een soort bacterie is het?
Escherichia coli O104:H4 is de naam. Een van de vele stammen van E. coli, die soms ziekmakende eigenschappen oppikt. O104:H4 bleek al snel een zeer toxische, agressieve stam. Om zijn exacte eigenschappen te bepalen, is serologisch onderzoek echter niet voldoende. Daarvoor moet je zijn erfelijke eigenschappen heel precies vergelijken met die van andere stammen. Dat hebben Duitse en Chinese onderzoekers vorige week gedaan met whole genome sequencing, niet 'diep' genoeg om het hele genoom in kaart te brengen, wel om voldoende genen te kunnen definiŽren.
De Duitse bacterie blijkt een soort mengelmoes van andere gevaarlijke E. coli bacteriŽn. De O104:H4-stam maakt een toxine aan dat lijkt op de gifstof van de dysenteriebacterie Shigella. Die Shigatoxine leidt tot bloederige diarree, nierfalen en soms de dood (het zogeheten hemolytisch-uremisch syndroom, kortweg Hus). Daarom wordt de bacterie een Ehec genoemd: het is een E.coli (ec) die leidt tot bloedingen in de darmen (Entero-hemorragisch, ofwel Eh).
Genetisch gesproken lijkt echter veel meer sprake te zijn van een Eaec, een (alleen bij de mens voorkomende) variant van de bacterie die makkelijk vastplakt aan de darmwand (vandaar de a, van aggregatief), en die een hardnekkige, waterige diarree veroorzaakt waaraan in derdewereldlanden elk jaar veel kinderen door uitdroging sterven.
Blattner vergeleek de voorlopige Chinees-Duitse uitkomsten met 14 genenkaarten in de database van het E.coli Genome Project en constateert dat de Duitse Ehec-stam 92 procent van het dna van een Eaec heeft. De O104:H4-stam heeft daarnaast overeenkomsten met Etec, de giftige bacterie achter reizigersdiarree (waarbij de t staat voor toxisch), en met de (minder) gevaarlijke Ehec-stam O157:H7. Die O157:H7-stam staat ook wel bekend als de hamburgerbacterie, omdat de eerste uitbraken, met name in de VS, het gevolg waren van besmet, onvoldoende verhit rundvlees.
Anders dan de vele tot nu toe bekende Ehec-stammen heeft O104:H4 ook een aantal antibioticaresistentiegenen. De bacterie is resistent tegen bijna alle antibiotica, net als de bekende Esbl-bacteriŽn (Extended Spectrum BŤta-Lactamase). Is hij daarmee ook een nieuwe mutatie, zoals de Wereldgezondheidsorganisatie vorige week bekendmaakte? Friedrich meent van niet. 'De O104:H4 is de afgelopen jaren vaker aangetroffen, maar dan ging het om sporadische casussen. Het enige opmerkelijke aan deze stam is de enorme resistentie.'
Ook bijzonder is dat de Duitse stam niet de traditionele Ehec-doelgroepen, kinderen en ouderen, lijkt te treffen, maar vooral volwassenen en dan met name vrouwen (70 procent van de gevallen). Waarom dat zo is, blijft voorlopig gissen, zegt Friedrich. Mogelijk eten vrouwen meer van bepaalde groenten of komen ze vaker met besmet voedsel in aanraking, omdat ze vaker voedsel bereiden voor het gezin. Of ze hebben andere receptoren in hun lichaam waardoor ze kwetsbaarder zijn.
Hoe is deze gevaarlijke Ehec-stam ontstaan?
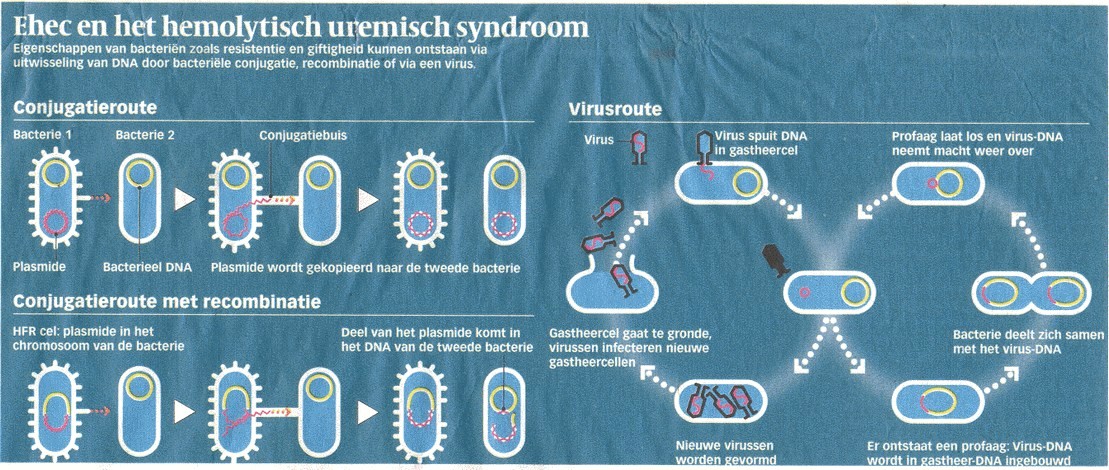
E. coli OlO4:H4 moet ergens in de gistende ingewanden van mens of dier zijn ontstaan. Darmen bieden de ideale omstandigheden -lekker warm, veel voedsel, miljarden bacteriŽn- voor nieuwe mutaties. En E. coli wisselt makkelijk genetische informatie uit, door zogenaamde horizontale genentransfer.
Dat kan op twee manieren. Via conjugatie, waarbij twee bacteriŽn contact leggen via contactbuisjes, zogeheten pili, waardoor dna van de een naar de ander verhuist. En via bacteriofagen, kleine virussen die alleen bacteriŽn infecteren en daarbij stukjes dna van de ene naar de andere bacterie kunnen overbrengen. Ook vervelende stukjes dna, zoals genen voor Shigatoxines of resistentie tegen antibiotica.
Die voortdurende genenuitwisseling is op zich niets bijzonders. Het genoom van E. coli-bacteriŽn is bezaaid met wel tweehonderd eilandjes van allerlei stukjes dna dat ze binnen en buiten de soort hebben opgepikt. Het is de manier waarop darmbacteriŽn evolueren, een dobbelsteen die altijd door rolt, voortgedreven door toeval en selectie.
Over de vraag waar de Duitse stam zijn genen vandaan heeft, verschillen wetenschappers nog van mening. Blattner denkt niet dat andere Ehec-bacteriŽn een rol spelen:"'Het enige gen van Ehec dat pathologisch relevant is, Intimin, zit er blijkens onze test niet in.' Misschien is de Ehec-bacterie een hybride van Eaec en Shigella, oppert hij, vanwege de Shigatoxine die kan zijn overgebracht door een bacteriofaag, maar dat lijkt hem een oversimplificatie. 'Er zijn meer factoren in het spel.'
De Chinese en Duitse onderzoekers denken daarentegen dat O104:H4 wťl een hybride product is van genentransfer tussen Eaec en Ehec. Friedrich merkt op dat de gifstof van de Duitse stam de Shigatoxine 2 is, die niet rechtstreeks afkomstig kan zijn van de Shigella-, maar van een (andere) Ehec-bacterie.
De precieze toedracht van het ontstaan van O104:H4 kan pas worden gereconstrueerd als het completŤ genoom van de stam in kaart is gebracht,' zegt Blattner, maar gezien zijn enorme antibioticaresistentie mag worden aangenomen dat hij in een omgeving is ontstaan waar darmbacteriŽn veel in aanraking komen met antibiotica. In een ziekenhuis dus of, waarschijnlijker, in de intensieve veehouderij. Juist onder koeien en andere herkauwers komen veel giftige E. coli-bacteriŽn voor.
Wat doen Ehec-bacteriŽn in de darm van de mens?
De Ehec-bacteriŽn komen met besmet voedsel binnen via de mond, omdat ze resistent zijn tegen zuur, passeren ze de maag moeiteloos. In de dikke darm plakken ze zich vast aan de darmwand, waar ze eerst een soort landingsplatform aanleggen. De microvilli, de minuscule uitstulpingen op de darmvlokken (bedoeld om het oppervlak van de darmen te vergroten zodat zoveel mogelijk voedingsstoffen kunnen worden opgenomen) worden weggemaaid, zodat de bacterie vaste grond heeft.
Daarna dwingen de bacteriŽn de darmcellen een soort zuiltje te vormen waar ze zich op kunnen nestelen. Friedrich laat foto's zien van gewone Ehec-infecties, die veel weg hebben van champignons, waarvan de hoed de bacterie is en de steel de darmwandzuil. De bacteriŽn kunnen zo eenvoudig hun gifspuit legen tussen de darmwandcellen.
de nieren vallen uit
Daarbij raakt de darmwand beschadigd, waardoor bloed in de ontlasting komt. Die beschadiging jaagt meteen hele colonnes bloedcellen naar de de darmen, klaar om de indringers uit te schakelen.
Maar de gifstoffen plakken aan de bloedcellen vast en liften zo onder meer mee naar de nieren. De niercellen hebben vervelend genoeg een receptor voor die gifstoffen zodat die aan de celwand van de niercellen blijft kleven. Gevolg: de cellen gaan binnen een paar uur kapot, de nieren vallen uit en de patiŽnt wordt ernstig ziek (Hus). Dieren hebben die receptor in de nieren niet.
Wat maakt de Ehec-bacterie zo gevaarlijk?
Van een salmonellabacterie moet je er tot een miljoen binnen krijgen om ziek te worden, van een Ehec-bacterie maar enkele. Eťn Ehec-bacteriekan in principe al voldoende zijn, zegt Blattner. Tien tot honderd sneldelende bacteriŽn zijn genoeg om de helft van de getroffenen ziek te maken.
De Duitse stam, O104:H4, bezit een dodelijke combinatie van agressieve factoren die het heeft overgenomen van andere ziekmakende darmbacteriŽn, en die hem een enorme voorsprong geeft in de darmen.
Elke Ehec heeft van de moederbacterie (de Eaec, waarvan hij ruim 90 procent van het genetisch materiaal heeft) een gen geŽrfd dat de productie van lijm door de darmen stimuleert. Daardoor blijft de bacterie makkelijk plakken aan de darmwand en kan hij zich snel vermenigvuldigen.
O104:H4 beschikt daarnaast over de gemeenste toxine uit het arsenaal, Shigatoxine 2, de gevaarlijkste van de twee gifstoffen die een Ehec-bacterie bij zich kan dragen. Als dat type 2 in je bloed komt, heb je ruim 15 procent kans op ernstige complicaties (een Hus), aldus Friedrich.
Nieuw, ťn gevaarlijk, is ook de antibioticaresistentie van de O104:H4-stam, die nooit eerder bij een Ehec-bacterie is waargenomen. De Ehec-stam reageert nog maar op twee groepen antibiotica, zware middelen die ernstige bijverschijnselen kunnen hebben. Niet dat het voor patiŽnten veel uitmaakt want een Ehec-besmetting (ook de stammen die niet resistent zijn) wordt nooit met antibiotica bestreden. Dat zet de bacterie namelijk zo onder druk dat de bacteriofagen worden geactiveerd. Zij zullen voordat de bacterie doodgaat verhuizen naar een andere bacterie en daarbij mogelijk het Shigatoxinegen verspreiden.
Pas als een patiŽnt erg ziek wordt, op de ic (intensive care) belandt en daar een ziekenhuisbacterie oploopt, zijn alsnog antibiotica nodig. Dan wordt noodgedwongen zwaar geschut ingezet om te voorkomen dat het middel dat de ene bacterie doodt, de andere juist activeert.
Nee, de resistentie is vooral gevaarlijk omdat het Ehec in de darm een grote voorsprong geeft op miljarden collegabacteriŽn. In Duitsland worden veel antibiotica voorgeschreven, zegt Friedrich. 'Stel dat iemand net een kuur heeft gekregen voor pakweg bronchitis, en dan Ehec-bacteriŽn binnenkrijgt, dan zal het antibioticum niet alleen de bacteriŽn in de longen doden maar ook die in de darmen.' Behalve de Ehecs, die leven daar juist van op, en blijven vervolgens zo'n beetje als enigen over.
Hoe verloopt de verspreiding van Ehec?
De Ehec-bacterie houdt zich op in de darmen van herkauwers, zoals koeien en schapen. De bacterie belandt op voedsel door besmetting via mest. Ook grondwater kan zo besmet raken.
De bacterie kan langdurig zelfstandig in leven blijven: maanden in de bodem en weken in water, rauwe melk of op voedsel en deurknoppen. Als mensen voedsel rauw of onvoldoende verhit of doorbakken eten, kunnen ze ziek worden.
Ook een besmetting van mens op mens is mogelijk, hoewel dat langzamer verloopt. In Duitsland liggen hele gezinnen in het ziekenhuis, vertelt Friedrich.
Dat de Ehec-bacterie resistent is tegen antibiotica, maakt de kans op verspreiding veel groter. Door het massale antibioticagebruik in de intensieve veehouderij krijgt de Ehec-bacterie een enorme voorsprong in de darmen van dieren: de hele darmflora ligt daardoor op zijn gat maar de Ehec-bacterie, ongevoelig voor de antibiotica, tiert welig verder.
De mest van dieren bevat zo grote hoeveelheden ziekmakende bacteriŽn die zich makkelijk verder verspreiden. Processen waar de evolutie eeuwen over doet, worden door het gebruik van antibiotica ernstig versneld.
Wat brengt de toekomst na de Ehec-epidemie?
De Ehec-stam die in Duitsland rondwaarde, is een blijver die zich wellicht ongemerkt verder zal verspreiden. Van alle besmette personen merkt 70 procent niets van die besmetting. Zij dragen de bacterie onwetend met zich mee. Pas als de bron van de besmetting wordt gevonden, kunnen er lessen worden getrokken om de voedselketen veiliger te maken en de onzekerheid onder consumenten te verminderen, zegt Kluytmans.
Dat is niet eenvoudig, leert de geschiedenis. De afgelopen decennia zijn Ehec-besmettingen (van andere stammen dan de Duitse) teruggevoerd op
- niet goed doorbakken hamburgers (VS, 1993, 500 zieken),
- radijssla in de schoolkantine (Japan, 9000 zieken, 11 sterfgevallen) of
- een kinderboerderij (Groot-BrittanniŽ, 93 zieken),
Wat de epidemie in Noord-Duitsland opnieuw duidelijk maakt, is dat er een enorm reservoir van potentieel gevaarlijke bacteriŽn op de loer ligt. De afgelopen jaren zijn er al een aantal van opgedoken: de mrsa-bacterie, bijvoorbeeld, en de esbl-producerende bacteriŽn, waaronder NDM-1, de superbug afkomstig uit New Delhi, meegenomen door toeristen. Steeds weer gaat het om darmbacteriŽn: naast E. coli lukt het ook de Klebsiella-bacterie om aan de antibioticatucht te ontkomen door steeds weer slimme mechanismen te ontwikkelen.
Wetenschappers speuren intussen naar manieren om de Ehec-bacterie sneller op te sporen en de resistentie aan te pakken. Microbiologen op het Ehec-lab in MŁnster bestuderen of bepaalde antibiotica kunnen voorkomen dat de Ehec-bacterie zijn gif loost.
TNO claimt een mengsel van natuurlijke ingrediŽnten te hebben ontdekt dat een multiresistente bacterie kan doden. Nature schrijft deze week dat Duitsland bij de ontdekking en bestrijding van de bacterie mogelijk op achterstand is gezet omdat hij zich in celkweken heel anders gedraagt dan bekende varianten van Ehec.
Onderzoek van monsters met ontlasting duurt daardoor dagen en mogelijk zijn misdiagnoses gesteld. Een dna-test kan dit ondervangen maar omdat het hele genoom van de stam nog niet in kaart is gebracht is een definitieve test nog niet beschikbaar. Hooguit kunnen nu andere Ehec-stammen worden uitgesloten. Bovendien worden zulke dna-tests in Duitsland niet vergoed.
BacteriŽn blijven muteren. Dat heet evolutie: ze schudden hun genoom als een pak kaarten en wisselen vrijelijk dna uit met andere bacteriŽn. 'Maar wij openen de deur om ze binnen te laten,' zegt Friedrich. Door massaal gebruik van antibiotica, het eten van besmet rauw voedsel, het verslepen van' voedingsmiddelen over de hele wereld, en slechte hygiŽne.
Het is hard nodig, zegt hij, om na te denken over de fundamentele achterliggende problemen van de epidemie. 'Er liggen nog tal van gevaarlijke bacteriŽn op de loer.'
BacteriŽn beschikken over heel geraffineerde methoden om zich meester te maken van onze lichaamscellen en ons afweersysteem om de tuin te leiden. Maar binnenkort kunnen we hen met hun eigen wapens verslaan.
De meeste bacteriŽn zijn heel beschaafd gezelschap. Als u zich ooit eenzaam voelt, moet u eens bedenken
dat er in en op een mensenlichaam biljoenen microben leven - tien keer zoveel als we lichaamscellen hebben.
Van de tienduizenden bekende bacteriesoorten zijn er maar een stuk of honderd schurken die zich niet houden
aan de regels van vreedzame coŽxistentie en ons ziek maken.
Deze ziekteverwekkers kunnen een hoop ellende veroorzaken. Infectieziekten zijn wereldwijd de op een na belangrijkste doodsoorzaak, en bacteriŽn veroorzaken een groot deel daarvan. Alleen al de tuberkelbacil eist jaarlijks bijna twee miljoen mensenlevens. En de beruchte bacterie Yersinia pestis, de veroorzaker van de builenpest, heeft in de veertiende eeuw bij benadering een derde van de Europese bevolking gedood. De wetenschap is er de afgelopen honderd jaar in geslaagd sommige soorten onder controle te krijgen met antibiotica, maar de schadelijke bacteriŽn hebben ook manieren ontdekt om zich tegen die medicijnen te verweren. Het is een wapenwedloop die de mens de laatste tijd begint te verliezen, deels doordat we onze vijand nog niet goed begrijpen.
Om erachter te komen hoe bacteriŽn ziekten veroorzaken, kweken microbiologen ze in een soepje van voedingsstoffen, isoleren moleculen uit het omhulsel van de microben of halen hun uitscheidingsstoffen uit het kweekmedium. Vervolgens onderzoeken ze welk effect die stoffen hebben op menselijke cellen of proefdieren. Op die manier hebben ze diverse bacteriŽle gifstoffen ontdekt, maar de meeste studies hebben vrijwel geen aandacht besteed aan de interacties tussen de ziekteverwekkende bacteriŽn en hun gastheer. De afgelopen twintig jaar is echter steeds duidelijker geworden dat ziekteverwekkende bacteriŽn zich in het laboratorium vaak heel anders gedragen dan in een gastheer.
| Ziekteverwekkende bacteriŽn vermenigvuldigen zich in ons lichaam en produceren daar giftige stoffen, maar tot voor kort wisten we niet precies hoe ze erin slagen ons afweersysteem te slim af te zijn. |
| Onderzoek aan de interacties tussen de bacterie en haar gastheer heeft aan het licht gebracht dat bacteriŽn gebruik maken van geraffineerde strategieŽn om de cellen van de gastheer te manipuleren en voor hun eigen karretje te spannen. |
| Deze nieuwe kennis van de wapens en tactieken van bacteriŽn stelt ons in staat nieuwe methoden te ontwikkelen om ze te bestrijden. |
Om de verschillende organen en weefsels binnen te dringen, in ons lichaam te overleven en zich voort te planten, ontwikkelen bacteriŽn zich tot getrainde terroristen die onze cellen en de communicatiesystemen van de cellen 'kapen'. Ze dwingen hen tot acties die in het belang zijn van de ziekteverwekkers. Verscheidene bacteriŽn nemen de leiding over door met specialŤ instrumenten eiwitten te injecteren die de machinerie van een cel zodanig herprogrammeren dat ze gaat doen wat de bacteriŽn willen. Van een paar soorten is zelfs bekend dat ze onschadelijke of heilzame bacteriŽn uit het lichaam verwijderen, zodat ze zelf als alleenheerser kunnen optreden. Zodra de onderzoekers de agressieve strategieŽn en ingenieuze wapens ontdekten die de ziekteverwekkende bacteriŽn gebruiken om hun gastheer binnen te dringen, zijn ze op zoek gegaan naar manieren om de microben te verslaan met hun eigen wapens.
Huisvredebreuk
De giftige stoffen die bacteriŽn uitscheiden vormen slechts ťťn oorzaak van de ziekten die ze teweegbrengen. Sommige symptomen van een bacteriŽle infectie zijn een direct gevolg van de tactieken die de microben gebruiken om te overleven. Omdat veel ziekteverwekkers gelijksoortige symptomen teweegbrengen -diarree, koorts en dergelijke- ligt het voor de hand te denken dat ze op een vergelijkbare manier ziekten veroorzaken. En het is waar dat veel ziekteverwekkers inwerken op dezelfde onderdelen van de machinerie van de cel, bijvoorbeeld op bepaalde eiwitten waaruit het inwendig skelet van de cel is opgebouwd. Maar ze maken toch gebruik van verbazend diverse en complexe aanvalsmethoden.
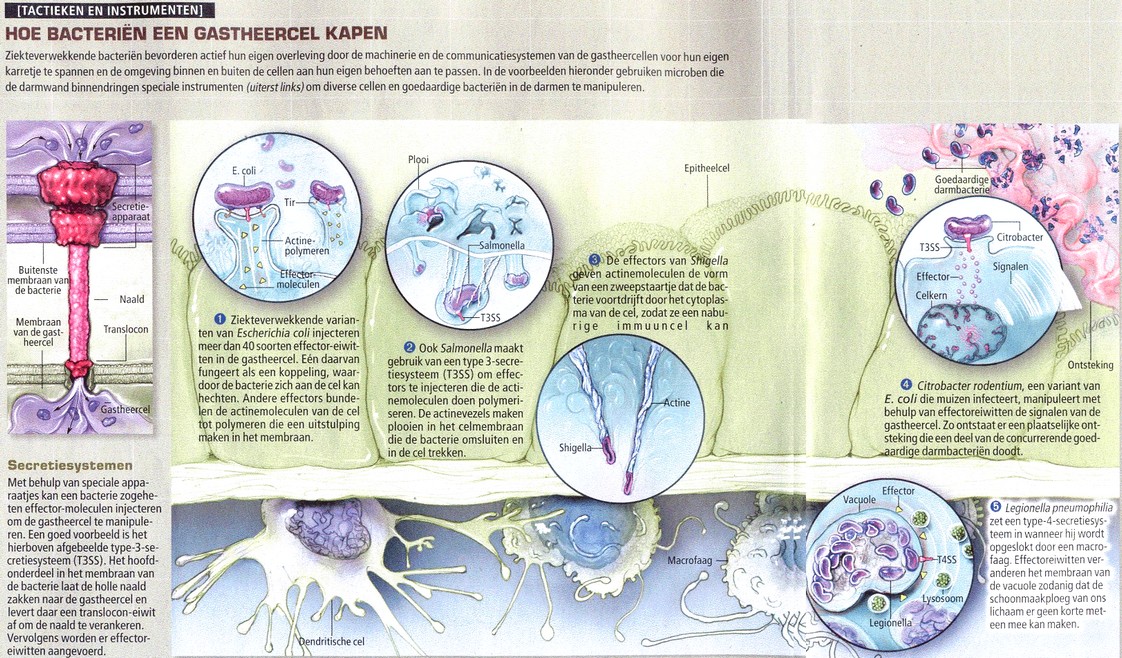
De eerste stap in elke aanval van een bacterie is dat hij zich hecht aan cellen van de gastheer.
Een ziekteverwekkende stam van Escherichia coli, bekend als hemorragische E. coli O157,
heeft misschien wel de meest opmerkelijke methode om zich in een gastheercel op te sluiten.
Deze ziekteverwekker krijgen we meestal binnen door het eten van besmet voedsel. Zodra
O157 zich in het maag-darmkanaal bevindt, hecht hij zich aan de darmwand en produceert
een gifstof die bloederige diarree veroorzaakt. Vroeger dachten de onderzoekers dat deze
kwaadaardige variant van E. coli zich net als alle andere adherente (klevende)
ziekteverwekkers aan een receptormolecule hecht die al aanwezig is op de darmcellen van de gastheer. Maar
uit recent onderzoek is gebleken dat O157 zijn eigen receptor maakt en die in de cel inbrengt
met behulp van een speciaal apparaatje, het type-3-secretiesysteem of kortweg T3SS.
Het T3SS van de bacterie injecteert een molecule met de naam Tir, samen met minstens
veertig zogeheten effector-eiwitten, rechtstreeks in het membraan van de gastheercel en maakt
dan een van zijn eigen oppervlaktemoleculen vast aan Tir. Maar dat is nog maar de eerste
stap in de verovering van de cel. Tir en een paar andere geÔnjecteerde effectormoleculen zorgen
er ook voor dat het interne skelet van de cel zich afwijkend gaat gedragen. Een cruciale
bouwsteen van het celskelet, actine, gaat interacties aan met de eiwitten van de bacterie en begint
polymeren te vormen die het celmembraan naar buiten duwen zodat het een soort sokkel vormt.
E. coli blijft zelf buiten de cel, stevig verankerd op zijn nieuwe troon, terwijl de
effector-eiwitten en de gifstoffen het vuile werk opknappen.
De precieze functie van deze merkwaardige sokkels is nog onbekend, maar inmiddels is wel
aangetoond dat ze onmisbaar zijn om een ziekte te kunnen veroorzaken.
Een ander potentieel dodelijke ziekteverwekker, Heliobacter pylori, hecht zich aan de epitheelcellen waarmee de maagwand is bekleed en begint dan zijn omgeving zo in te richten dat hij er beter kan overleven. H. pylori scheidt een enzym uit, urase, dat plaatselijk de hoge zuurgraad van de maag verlaagt, die normaliter de meeste bacteriŽn doodt. Niet alle stammen van H. pylori veroorzaken een ziekte, maar sommige kunnen tot maagzweren en zelfs maagkanker leiden. De ziekmakende stammen produceren een type-4-secretiesysteem dat een effector-eiwit injecteert met de naam CagA. Het is niet duidelijk waar dit eiwit precies voor dient, maar recent onderzoek doet vermoeden dat het de epitheelcellen van de maag ertoe aanzet meer van de receptoren te laten zien waaraan H. pylori zich vasthecht. Het effector-eiwit kan ook direct het interne seinsysteem van de maagwandcellen zodanig veranderen dat ze uitgerekt worden, zich verspreiden en uiteindelijk sterven, wat bijdraagt tot het ontstaan van een maagzweer.
E. coli O157 en H. pylori hoeven een cel niet binnen te dringen om een ziekte te veroorzaken, maar Salmonella, een soort die jaarlijks meer dan een een miljard mensen diarree bezorgt, gaat wel door de celwand heen. Om zich te kunnen vermenigvuldigen moet hij de epitheelcellen binnendringen waarmee de ingewanden zijn bekleed. Deze invasie begint wanneer de bacterie met behulp van een T3SS-variant, die bekendstaat als het Salmonella pathogenicity island 1 (SPI-1), epitheelcellen injecteert met effector-eiwitten die de actine-polymerisatie zodanig wijzigen dat er plooien ontstaan in het celmembraan - zoals de sokkel van E. coli. Deze plooien omhullen een bacterie die zich aan de buitenkant van het membraan heeft vastgemaakt en grijpen hem beet, zodat de cel hem letterlijk naar binnen trekt. Moleculen die met het SPI-1 zijn geÔnjecteerd, veroorzaken ook de diarree die kenmerkend is voor dit soort infecties, maar de Salmonella-bacterie laat het daar niet bij.
| HET MENSELIJK LICHAAM BEVAT 10 biljoen lichaamscellen 100 biljoen bacteriecellen. |
| IN ONZE DARMEN LEVEN 5.000 ŗ 35.000 bacteriesoorten. |
| IN DE MOND 300 ŗ 500. |
| EN OP DE HUID 120 |
| 100 bacteriesoorten veroorzaken ziekten bij de mens |
|
PERCENTAGE MENSEN DAT EEN EEN VEEL VOORKOMENDE ZIEKTEVERWEKKER BIJ ZICH DRAAGT
(IN VEEL GEVALLEN ZONDER OOK WERKELIJK ZIEK TE ZIJN)
Mycobacterium tuberculosis
Heliobacter pylori
Staphylococcus aureus |
Normaliter worden ongewenste indringers opgeslokt en vernietigd door macrofagen en
andere cellen, zoals neutrofielen en dendritische cellen - een proces dat fagocytose heet.
De fagocyten omhullen de bacteriŽn en sluiten ze op in vacuolen (blaasjes) op het membraan, waar
ze worden vernietigd door dodelijke moleculen.
Maar Salmonella passeert de darmwand door via de epitheelcellen over te stappen op de
immuuncellen die aan de andere kant zitten te wachten. Zodra de bacterie zich in de fagocytische
vacuole bevindt, brengt ze een tweede T3SS in stelling, die SPI-2 heet. Die scheidt effectoreiwitten
uit die de vacuole veranderen in een veilige haven voor Salmonella, waar hij zich kan
vermenigvuldigen. Die transformatie van dodencel tot toevluchtsoord bewerkstelligen de eiwitten
door het membraan van de vacuole zodanig te veranderen dat de dodelijke moleculen niet binnen kunnen komen.
Dit SPI-2-systeem is van cruciaal belang voor het succes van Salmonella typhi, de bacteriestam die buiktyfus veroorzaakt. SPI-2 stelt de microben in staat te overleven binnen de fagocytische cellen, die via de bloedbaan en het lymfesysteem door het hele lichaam reizen. Op die manier kan de bacterie vanuit de darmen allerlei andere weefsels bereiken, zoals de lever en de milt, en zich daar vermenigvuldigen.
Het vermogen om lange tijd in de gastheercellen in leven te blijven is een gemeenschappelijk kenmerk van veel bacteriele ziekteverwekkers, waaronder de veteranenziekte. Deze Legionella pneumophila injecteert via zijn T4SS minstens tachtig verschillende effector-eiwitten in (de) fagocytische cellen. Hoewel van slechts een paar de functie bekend is, weten we wel dat sommige ervan dienen om de fagocytische vacuole om te toveren tot een veilig toevluchtsoord.
Het gedrag van Legionella leert ons ook iets over de vermoedelijke oorsprong van de secretiesystemen van bacteriŽn. Die hebben zich in de loop van de evolutie kennelijk ontwikkeld om de microben te beschermen tegen aanvallen door eencellige organismen in de bodem. Normaliter gebruikt Legionella zijn T4SS om te overleven wanneer hij wordt opgeslokt door een in de bodem levende amoebe. Zulke amoeben vertonen een aantal mechanismen die sterk lijken op die van de fagocytische cellen van de mens.
De schildwacht te slim af
Het vermogen van bacteriŽn om zich comfortabel te nestelen in immuuncellen -de cellen die
hen eigenlijk zouden moeten doden- maakt wel duidelijk dat ze over een veelzijdige gereedschapskist
beschikken om de machinerie van de cel aan hun eigen behoeften aan te passen. De
overeenkomst tussen menselijke immuuncellen en organismen die het buiten de mens op bacteriŽn hebben gemunt,
kan ook de oorsprong van andere overlevingsstrategieŽn verklaren.
Enkele van de meest vernuftige mechanismen proberen de verdedigingslinies van de gastheer
te omzeilen en zelfs de immuuncellen voor het karretje van de ziekteverwekker te spannen.
Yersinia pestis wordt bijvoorbeeld van ratten op de mens overgebracht via vlooienbeten, waarbij de bacterie direct in het bloed komt. Wanneer fagocytische cellen proberen de ziekteverwekker op te slokken en te doden, injecteert het T3SS van Yersinia minstens vier verschillenÍle effector-eiwitten. Daardoor raken de immuuncellen verlamd voor ze hun prooi kunnen verslinden. De bacterie blijft aan het oppervlak van de fagocyten kleven en wordt meegevoerd naar de lymfeklieren, waar ze zich begint te vermenigvuldigen en de pijnlijke zwellingen veroorzaakt waaraan de builenpest zijn naam te danken heeft.
Veel ziekteverwekkers hebben secretie- en injectiesystemen waarmee ze het seinsysteem en
de afweerreacties van een cel kunnen herprogrammeren. Shigella dysenteriae biedt een mooi
voorbeeld van het scala aan tactieken dat een bacteriesoort kan aanwenden in de loop van een
infectie. Shigella beschikt over een T3SS dat 25 ŗ 30 effector-eiwitten injecteert die
gastheercellen ertoe aanzetten de microbe op te nemen.
Vervolgens gebruikt de bacterie de machinerie van het celskelet om door de cel te reizen en een
naburige cel binnen te dringen, zodat ze eventuele ontmoetingen met immuuncellen en
antilichamen vermijdt.

De overige mechanismen waarover Shigella beschikt, zijn nog niet geheel opgehelderd, maar we weten wel dat verscheidene van zijn effectoreiwitten de interne seinsystemen van de gastheercel zodanig beÔnvloeden dat een deel van de alarmsignalen geneutraliseerd wordt. Maar niet alle. Shigella maakt gebruik van het feit dat sommige signalen dendritische cellen naar de plaats van de infectie roepen. Hij dringt die fagocytische cellen binnen en laat zich als het ware in een Paard van Troje door de darmwand vervoeren. Daarbij raakt de darmwand geÔrriteerd, wat leidt tot de hevige diarree die kenmerkend is voor dysenterie.
BacteriŽn zijn niet alleen het aangeboren immuunsysteem te slim af. Sommige hebben ook
geleerd het verworven afweersysteem te omzeilen, dat bestaat uit T-cellen en B-cellen die
getraind zijn om ziekteverwekkers te herkennen aan uiterlijke kenmerken, de antigenen.
De microben kunnen aan deze verdedigingsmechanismen ontkomen door ofwel de eiwitten van hun
oppervlak voortdurend te veranderen, zodat de antistoffen hen niet herkennen, ofwel enzymen
uit te scheiden die de antistoffen verzwakken.
Shigella en verscheidene andere pathogenen kunnen zelfs voorkomen dat er Łberhaupt
antistoffen worden aangemaakt. Ze verhinderen de fagocytische cellen antigenen te presenteren aan
de cellen van het verworven immuunsysteem.
Salmonella kan ook een cascade van signalen op gang brengen die de fagocytische cellen ertoe
aanzet zelfmoord te plegen voor ze in contact kunnen komen met cellen van het verworven
immuunsysteem.
Concurrenten elimineren
Om in een mensen lichaam te gedijen, is het niet voldoende dat ziekteverwekkers het seinsysteem van de cel manipuleren en het immuunsysteem om de tuin leiden. Ze moeten ook talrijker worden dan de zwermen goedaardige bacteriŽn die in en op het lichaam leven - spelers die de meeste microbiologen en immunologen tot voor kort vrijwel genegeerd hebben. Alle oppervlakken van het lichaam die blootstaan aan de omgeving, inclusief de wand van het maag-darmkanaal, zijn bezaaid met gigantische hoeveelheden 'kostgangers'. Zo bevat elke gram darminhoud bij benadering zestig miljard bacteriŽn.
Een van de meest voorde hand liggende methoden om de concurrentie uit te schakelen is diarree veroorzaken en zo de tegenstanders uit het lichaam spoelen. Mijn collega's en ik hebben aangetoond dat een muizenvariant van de ziekteverwekkende E. coli,die bekend staat als Citrobacter rodentium, met opzet een ontsteking van de ingewanden veroorzaakt. Daarbij snellen cellen van het aangeboren immuunsysteem toe en doden een specifiek deel van de micro-organismen die normaliter in de darmen van een muis leven. Zodra deze concurrenten uit de weg zijn geruimd, kunnen de ziekteverwekkers zich razendsnel vermenigvuldigen. Ze blijven dominant tot het verworven immuunsysteemin actie komt. Uiteindelijk elimineren de immuuncellen de ziekteverwekkers, waarna de normale darmflora zich herstelt.
Er bestaat ook een muizenvariant van Salmonella, die zich aanpast aan de toestand van de normale 'inwonende' microben van de gastheer. Deze bacterie veroorzaakt bij muizen gewoonlijk een tyfusachtige ziekte. Maar wanneer de normale darmflora van tevoren wordt veranderd door de muizen hoge doses antibiotica toe te dienen, veroorzaakt de bacterie een ziekte die beperkt blijft tot het maag-darmkanaal. Kennelijk zet de concurrentie van de 'in- wonende' darmbacteriŽn Salmonella ertoe aan het hele lichaam binnen te dringen, maar als de normale flora is veranderd, beperkt Salmonella zich tot de darmen.
De interacties tussen microben in het lichaam van de gastheer bieden de ziekteverwekkers ook de gelegenheid wapens uit te wisselen en zich van nieuwe wapens te voorzien. En inderdaad zijn veel ziekteverwekkers geŽvolueerd uit onschadelijke microben door genen te verwerven die hen nieuwe eigenschappen schonken. In dat opzicht kunnen we de darmen beschouwen als een groot genetisch internet, waar de bacteriŽn genen kunnen uitwisselen die coderen voor 'virulentiefactoren'. Dat zijn instrumenten en trucs die de schadelijkheid van een bacterie vergroten, zoals secretiesystemen of effector-eiwitten.
Het verwerven van nieuwe pathogene 'genomische eilanden' biedt een bacterie een voordeel, want het stelt haar in staat nieuwe soorten gastheren te koloniseren of agressiever te worden. Zo vermoedt men dat de dodelijke E. coli O157 voor het eerst aan het eind van de jaren '70 op het toneel is verschenen, toen een relatief goedaardige E. coli een genomisch eiland verwierf dat codeert voor een nieuw T3SS en een gen voor het Shiga-toxine - eigenschappen die hevige diarree en een ernstige nieraandoening teweegbrengen.
Nieuwe wapens
De ontdekking van injectiesystemen en andere instrumenten van ziekteverwekkers heeft nieuwe ideeŽn opgeleverd voor behandelmethoden. Bij de klassieke aanpak worden bacteriecellen direct vernietigd met antibiotica. Mijn onderzoeksteam maakt bijvoorbeeld dankbaar gebruik van onze kennis van secretiesystemen voor een nieuw vaccin tegen E. coli O157.
Dat bevat delen van het T3SS van de ziekteverwekker en verscheidene van zijn effector-eiwitten, zodat het verworven immuunsysteem kan leren die eiwitten onmiddellijk te herkennen en te neutraliseren. Het vaccin beschermt de mens alleen indirect, want het is bedoeld voor koeien. Ongeveer de helft van al het rundvee draagt E. coli O157 bij zich zonder er last van te hebben, maar via de uitwerpselen kan de bacterie in levensmiddelen en drinkwater terechtkomen. Door O157 bij de bron te elimineren, kan het vaccin -dat in Canada al aan koeien wordt toegediend en in de Verenigde Staten binnenkort wordt goedgekeurd- helpen voorkomen dat O157 zijn weg vindt naar een menselijke gastheer.
Tal van onderzoekers experimenteren met andere creatieve methoden om ziekteverwekkers te bestrijden. Zodra de virulentiefactoren van een bacterie bekend zijn, kunnen we behandelmethoden ontwikkelen die haar onschadelijk maken doordat ze de genen uitschakelen die voor deze factoren coderen. Een verwante strategie is moleculen te maken die de adhesiemoleculen van een bacterie blokkeren, zodat ze zich niet aan de gastheercellen kan hechten. Van ťťn middel dat kan voorkomen dat E. coli zich hecht is de werkzaamheid bij mensen al aangetoond, en vergelijkbare medicijnen verkeren in een vroeg stadium van ontwikkeling.
Een andere intrigerende mogelijkheid is voorkomen dat de microben met elkaar communiceren. BacteriŽn als E. coli bepalen hun positie in de darm door te 'luisteren' naar chemische signalen van normale micro-organismen en gastheercellen. Die informatie speelt een rol bij hun beslissing om tot de aanval over te gaan. Een andere ziekteverwekker -Pseudomonas aeruginosa- vormt kolonies (de zogeheten biofilms) in de longen. Onderzoekers van de Universiteit van Kopenhagen hebben onlangs aangetoond dat onderdelen van zo'n biofilm signalen uitzenden die waarschuwen voor naderende immuuncellen, zodat de andere bacteriŽn de gelegenheid hebben om een peptide uit te scheiden dat de immuuncellen doodt.
Een belangrijk voordeel van deze aanpak is dat hij zich richt op mechanismen in de bacterie
die ons ziek maken, maar die niet essentiťel zijn voor het overleven van de bacterie buiten het
menselijk lichaam. In tegenstelling tot traditionele antibiotica, die de ziekteverwekkers regelrecht doden,
blokkeren de nieuwe behandelmethoden alleen hun communicatiemechanismen en andere schadelijke mechanismen,
zodat ze onschadelijk worden maar wel inleven blijven.
Het gevolg is dat ze waarschijnlijk minder snel resistent worden, of zelfs helemaal niet.
Brave cellen helpen
Een nog indirectere manier om ziekteverwekkers te bestrijden is hun omgeving vijandig te maken. Tal van onderzoekers zijn naarstig op zoek naar methoden om de goedaardige 'inwonende' bacteriŽn zodanig te veranderen dat ze ziekteverwekkende bacteriŽn weg kunnen concurreren. Het principe van het toedienen van probiotica (onschadelijke bacteriŽn als Lactobacillus) en prebiotica (suikers die de groei van heilzame bacteriŽn bevorderen) is algemeen bekend, en veel mensen gebruiken producten als yoghurt om de hoeveelheid goedaardige 'kostgangers' in hun darmflora te vergroten. Maar deze methoden zijn nog niet strikt genoeg getest om te bepalen welke goedaardige bacteriŽn het heilzaamst zouden zijn. Er zijn bovendien nog geen microben ontdekt die krachtig genoeg zijn om een bestaande infectie te bestrijden.
De onderzoekers hebben echter meer vorderingen gemaakt als het gaat om het versterken
van het vermogen van de immuuncellen om ziekteverwekkers af te weren. Veel stoffen die
het immuunsysteem stimuleren worden al op uitgebreide schaal toegepast als toevoegingen
aan vaccins, zonder schadelijke bijwerkingen.
En verscheidene biotechnologiebedrijven ontwikkelen nieuwe middelen die de natuurlijke afweerreacties
moeten versterken of verfijnen. Deze stoffen kunnen dienen om andere therapieŽn te ondersteunen of
zelfs om bestaande infecties te bestrijden.
Het grootste obstakel op dit onderzoeksgebied is misschien wel dat we de heilzame aspecten van een
ontsteking (normaliter moet die de benodigde immuuncellen mobiliseren) los te koppelen van een te actief
ontstekingsniveau, dat de gastheer kan schaden. Er is echter goede hoop dat dat obstakel overwonnen kan worden.
Zo heeft mijn onderzoeksteam, samen met Robert Hancock van de Universiteit van British Columbia
onderzoek gedaan naar de verdedigingspeptiden van een gastheer: kleine eiwitten
die worden geproduceerd door immuuncellen in reactie op ziekteverwekkers.
Sommige van deze peptiden boren zich direct door het cel membraan van de microbe om de indringer te doden, andere fungeren als signaalmoleculen die extra hulptroepen mobiliseren. Een van de peptiden die we hebben ontdekt, IDR-l genaamd, behoort tot de laatstgenoemde groep. Ze zorgt ervoor dat de dendritische cellen chemische signalen uitzenden om macrofagen te mobiliseren in de strijd tegen ziekteverwekkers, maar zet de dendritische cellen niet aan tot signalen die een uit de hand lopende ontsteking kunnen veroorzaken. Bij dierproeven is al gebleken dat de molecule de ontsteking remt en tegelijk de reactie van de gewenste immuuncellen versterkt.
Het ziet er dus naar uit dat het mogelijk is microben met hun eigen wapens te verslaan. Als bacteriŽn kunnen leren de seinmechanismen van de menselijke immuuncellen te manipuleren, dan kunnen wij dat ook. Onze kennis van de manieren waarop bacteriŽn ziekten veroorzaken is de afgelopen twintig jaar exponentieel toegenomen. Ziekteverwekkers zijn samen met hun gastheren geŽvolueerd en hebben daarbij hun trukendoos buitengewůon geperfectioneerd en op hun gastheer afgestemd. Gelukkig beschikken niet alleen de microben over een indrukwekkend arsenaal aan trucs, maar de mens ook.
Door het bestuderen van de opmerkelijke methoden die bacteriŽn gebruiken om hun gastheren aan te vallen en om de tuin te leiden, zijn we meer gaan begrijpen van afweerreacties en ziekteprocessen. Deze toenemende kennis stelt onderzoekers nu al in staat nieuwe manieren te bedenken om bacteriŽle infecties te voorkomen en te behandelen - en daar is grote behoefte aan.
Kort nieuws uit de Volkskrant 30 mei 2009, p. K 1.
Broeinest
De menselijke huid huisvest meer bacteriŽn dan tot nu toe is aangenomen. Dat schrijven Amerikaanse onderzoekers
in Science.
Zij namen bij proefpersonen huidmonsters af op twintig plekken.
De grootste verscheidenheid troffen zij aan op de onderarm (gemiddeld 44 soorten),
de kleinste achter het oor (19).
DNA-onderzoek wees uit dat de bacteriŽn behoorden tot 19 verschillende stammen en 205 geslachten, veel meer
dan bekend.