De leer die betrekking heeft op immuniteit en op de immunobiologische reacties.
Zie virtual biology voor MHC Processing etc.
Toekomstgericht OnderzoeksPlatform Infectieziekten - TOPIZ.
Leids Universitair Medisch Centrum.
- Ellen de Visser (2011) - Cellen afweersysteem geven hun (300) geheimen prijs.
Volkskrant, 2 april 2011, p. 15. (Art. over de bevindingen van de groep van Jacques Neefjes: Zie hieronder.) - Matthew Morrow en David Weiner (2010) - DNA-medicijnen worden volwassen.
Scientific American (Ned. Uitg.) sept/okt. p.60-65 (Art.: Zie hieronder) - Huup Dassen (2010) - Steriele bloedergiftiging bij ongeluksslachtoffers komt door mitochondriŽn.
NRC 8 mrt. p. W.7 (Zie hieronder). - Djoke Hendriks (2009) - Afweer tegen infectie is vooral goed als T-cellen snel delen.
NRC 5 sept. p. W.17 (Zie hieronder) - Huup Dassen. Virusmedicijn laat de afweer de geÔnfecteerde cellen vernietigen.
NRC Wetenschap 29 nov. 2008, p. 5. (Artikel zie hieronder.) - Nienke van Trommel. Falende macrofagen bezorgen muizen auto-immuunziekte.
NRC 5 juni 2004, p. 47. (Artikel zie hieronder.) - John J.L. Jacobs; Tumor immunologie: je afweersysteem vecht tegen kanker.
Mens & Wetenschap, jrg. 30, dec. 2003, p. 421-425.
Samenvatting zie hieronder. Tevens mooi overzicht van verschillende systemen die een rol spelen bij de afweer. - Afweer door wormen. Gelders Dagblad (Stentor), 25 nov. 2003.
Schistosoma, vroeger Bilharzia genoemd, een parasitaire zuigworm die schistosomiase veroorzaakt, bevatten vetten die de sterkte van het afweersysteem kunnen onderdrukken. De vetten zijn daardoor mogelijk te gebruiken als medicijn tegen ziektes waarbij de afweer uit de hand is gelopen, bijv. diabetes en astma. - Sperma als medicijn. Stentor 23 sep. 2003 p. BY1WEL
Abstract hieronder. - Effect Wegener-ziekte. Gelders Dagblad 1 april 2003 p. BY1WEL.
(Zie hieronder).
- Celgroei leidt tot afstoting. Bionieuws 24 nov p.3.
- Sander Voormolen (2001). Verbeterde afweer gaat ten koste van de vruchtbaarheid.
NRC 11 aug. p. 33.
- A.M. Vlieger et al (2000). Immunologie in de medische praktijk XXXII.
Transplantatie van autologe hematopoŽtische stamcellen voor behandeling van
therapie-resistente auto-immuunziekten; eerste gunstige ervaring bij 35 patiŽnten.
NTG 12 aug.; 144(33); p. 1588-93.
- M. van Deuren (2000). Immunologie in de medische praktijk XXVII.
Mannosebindend lectine, een belangrijke schakel in de aspecifieke
of aangeboren afweer.
NTG 17 juni; 144(25): p. 1214-9.
- J.P.H. Drenth, H.R. Waterham, W. Kuis, S.M. Houten, J. Frenkel, R.J.A.
Wanders, B.T. Poll-The en J.W.M. van der Meer (2000).
Identificatie van het gen voor het hyper-IgD-syndroom: een
schoolvoorbeeld van moderne genetica.
NTG 22 april; 144(17, p.782-85.
- Erick Vermeulen (2001). Kunstklier levert afweercellen. N&T, febr. p. 15.
- Paul van Laere (2001). Zinloze afweer - Virussen en de paradox van preventie.
Kuzien Winter 2000-2001, p.8-9.
Behandeling van de inaugurele rede van Prof. dr. Joep Galama, waarmee hij 2 feb 2001 zijn hoogleraarschap in de virologie aan de KU Nijmegen aanvaardde. (Topic: Toename allergie) De samenvatting door Paul van Laere staat hieronder. - Wim KŲhler (2000). Goede darmbacteriŽn verhinderen zelf ontstekingsreactie.
NRC 16 sep, p.51, k.1-4.
Geen gewenning, maar stoffen die het afweersysteem blokkeren. Is dit een stap naar probiotica, stoffen (Il-10) die ontstekingen voorkůmen in de darm? - Martine Segers (2000). 'Op plantencongressen zie je steeds meer
medici'. Bionieuws 13, 26 aug. jrg. 10. p.4, k.1-5.
het onderzoek naar resistentiegenen die ook toepasbaar zijn voor de mens komt nu van de grond. - Rinze Benedictus (2000). Muizen eten zich gezond. Bionieuws 13,
jrg. 10, 26 aug. p.5.
Muizen met ulceratieve colitis en de ziekte van Crohn kregen gemodificeerde bacteriŽn Lactobacillus lactis te eten. Deze bacterie scheidt Il-10 als ontstekingsremmer uit. - Wim KŲhler (2000), GM-lactococcen met Il-10 verlichten darmontstekingen.
NRC 26 aug. p.45, k.1-5.
IL-10 = interleukine 10. - Immunologie - Een heldere uitleg over
allerlei zaken het immuunsysteem betreffend en aangereikt door de site
'How Stuff Works'. Voor de Anglofielen een aanrader het origineel te lezen.
- Gerbrand Feenstra. 2000. Orale seks behoedt de zwangere vrouw.
Volkskrant. 17 juni. p.5W. k.1-5.
Een bespreking van een studie van vrouwenartsen en immunologen van de VUA en het LUMC (Leids Universitair Medisch Centrum) in het vaktijdschrift Journal of Reproductive Immunology, maart 2000. - Wim KŲhler. 2000. Orale seks voorkomt misschien complicatie bij
zwangerschap. NRC 10 juni. p.51. k.5-7.
Een bespreking van een artikel in het blad Cicero (9 juni 2000) van het LUMC over fellatio. Eerder al verscheen een artikel in het vaktijdschrift Obstetrical and Gynecological Survey (juni 1998) waarin dit aannemelijk werd gemaakt. - Lex Veldhoen (2000). Gif met tegengif - Met de Irula's op slangenjacht.
Natuur en Techniek, juni, p.34-37
- Nienke van Trommel. 2000. Gentherapie helpt baby's met ernstige
afweerziekte SCID-XI. NRC 6 mei. p.51. k.6-7.
- Wim KŲhler (2000) Afweercel herkent stervende cel aan fosfatidylserine. NRC 6 mei. p.57.
Van onze verslaggever Ellen de Visser
AMSTERDAM Wetenschappers van het Nederlands Kanker Instituut (NKI) hebben ontdekt hoe een van de belangrijkste controlemechanismen van het afweersysteem werkt. Ze testten alle menselijke eiwitten en vonden er driehonderd die de werking van de moleculen aan de buitenkant van de immuuncellen beÔnvloeden.
Door hun vondst kan de komende jaren gericht worden gezocht naar geneesmiddelen waarmee het immuunsysteem is te manipuleren. Het onderzoeksteam, onder leiding van hoogleraar Jacques Neefjes, heeft de bevindingen gepubliceerd in Cell.
Het controlesysteem werkt via zogeheten MHC-II moleculen, die zich op de afweercellen bevinden, legt Neefjes uit. Die fungeren als presenteerblaadjes die stukjes eiwit van een virus, een bacterie of een kankercel laten zien aan de T-cellen van het afweersysteem.
Die T-cellen kunnen geÔnfecteerde cellen of kankercellen doden. Maar als ze te krachtig werken, zijn de MHC-II moleculen verantwoordelijk voor auto-immuun ziekten zoals gluten-allergie en MS. De verscheidenheid aan MHC-moleculen is bovendien groot en voor ieder mens specifiek. Daardoor ontstaan vaak afstotingsverschijnselen na een transplantatie.
De MHC-moleculen brengen bij ziekteverwekkers een nuttige afweer op gang maar zijn ook betrokken bij de keerzijde van dat afweersysteem, aldus Neefjes. 'Daarom is het van belang te weten hoe die moleculen werken en worden gecontroleerd.'
Om daar achter te komen, testten vijf onderzoekers uit de groep van Neefjes alle 23 duizend menselijke
eiwitten in weefselkweken. De eiwitten werden een voor een uitgeschakeld zodat het effect op de
MHC II-moleculen kon worden bestudeerd.
Zo vonden ze driehonderd eiwitten die de hoeveelheid MHC-II moleculen bleken te beÔnvloeden. Daarvan
waren er 150 onbekend.
De NKI-onderzoekers vergeleken hun lijst met de lijst van eiwitten die ooit door andere onderzoekers
waren ontdekt bij patiŽnten met een auto-immuunziekte. Twintig ervan konden zo in verband worden
gebracht met een auto-immuunziekte.
Neefjes: 'De rol van die eiwitten bij het ontstaan van de ziekte was onduidelijk, wij kunnen nu aantonen
dat ze van invloed zijn op de MHC-moleculen op de afweercellen.'
De onderzoekers onderzochten daarna welk effect die driehonderd eiwitten hebben op het functioneren van de MHC-II moleculen. Ze bepaalden ketens van eiwitten die elkaar controleren en onthulden zo voor het eerst het systeem van de biologie van de afweerreaktie.
Het MHC, Major Histocompatibility Complex, is een deel van het genoom, bij mensen HLA (human leucocyte antigen) genaamd, dat codeert voor eiwitten (glycoproteÔnen) die zich aan de oppervlakte van veel zoogdiercellen bevinden en die een belangrijke rol spelen bij de herkenning van 'eigen' en 'niet-eigen' elementen in het lichaam. Het gaat om ongeveer 140 eiwitten die verschillende functies vervullen.
In mensen ligt het MHC gecodeerd op de korte arm van chromosoom 6. Tussen de codering van MHC-II en MHC-I ligt de genetische code voor complement (MHC-III) en cytokines.
Het allel voor
MHC-I bestaat uit drie loci die A, B en C worden genoemd,
MHC-II beslaat ook drie loci (DP, DQ en DR).
MHC-I
- moleculen zijn aanwezig op de buitenkant van alle gekernde cellen in het menselijk lichaam
en op bloedplaatjes. Het molecuul is een dimeer dat op ťťn plaats in het celmembraan ligt verankerd.
MHC-I moleculen presenteren 8-11 aminozuren van alle eiwitten die in een cel worden geproduceerd.
Als een cel geÔnfecteerd is geraakt door bijvoorbeeld een virus, zal de cel de viruseiwitten die het virus
produceert uit het cytosol vissen en presenteren op het MHC-I (als op een dienblaadje).
Het viruseiwit wordt dan antigeen genoemd. Verschillende cytotoxische T-cellen zullen kijken of hun
antigeenreceptor past op het gepresenteerde stukje antigeen. Als het klikt, zal de T-cel een
FAS-binding tot stand brengen en perforines en granzyme uitscheiden. Perforines doorboren als kokertjes
het celmembraan van de geÔnfecteerde cel en granzyme gaat door die kokertjes naar binnen om de cel
(en daarmee ook het virus) te vernietigen.
MHC-II
- moleculen zijn alleen aanwezig op de buitenkant van antigeen-presenterende cellen.
Het molecuul is een dimeer dat op twee plaatsen in het celmembraan ligt verankerd.
MHC-II moleculen presenteren 9-30 aminozuren van eiwitten die via endocytose de cel zijn binnengekomen.
Als een macrofaag een ziekteverwekker heeft gefagocyteerd (opgegeten) en gelyseerd (verteerd) dan knipt hij daarna stukjes van de eiwitten van de ziekteverwekker en presenteert die op het MHC-II. Verschillende T-helpercellen zullen kijken of hun antigeenreceptor past en als het klikt zal de cel B-cellen aanzetten tot het produceren van antistoffen die werken op het specifieke antigeen.
T-cellen leren het lichaamseigen MHC kennen tijdens hun ontwikkeling. Als een transplantaat met een niet overeenkomend MHC wordt ingebracht, zullen de T-cellen een afstotingsreactie in gang zetten.
Al tientallen jaren leeft de hoop dat ontwikkelingen op het gebied van de
DNA-technologie het mogelijk zullen maken allerlei ziekten te genezen of te
voorkomen. Met horten en stoten zijn de onderzoekers erin geslaagd DNA-
vaccins en DNA-medicijnen te ontwikkelen die al bij dieren worden
toegepast en inmiddels ook bij mensen worden getest.
Door Matthew Morrow en David Weiner
SAMENGEVAT
Maar in de eerste test vielen de resultaten bitter tegen.
Daardoor is hun werkzaamheid drastisch verbeterd.
Tien jaar geleden was er een nek-aan-nek-race gaande tussen twee veelbelovende
nieuwe types vaccins. Onderzoekers van de Amerikaanse Institutes of Health testten
welk type de beste bescherming bood tegen een van de dodelijkste virussen die er bestaan: hiv
(human immunodeficiency virus), dat aids veroorzaakt.
Het ene vaccin bestond uit
cirkelvormige strengen DNA, zogeheten plasmiden, die elk een gen bevatten dat codeerde voor een
hiv-eiwit. In totaal ging het om vijf verschillende genen. De bedoeling was dat de lichaamscellen
van de ontvanger de virus-eiwitten zouden gaan produceren en op die manier een beschermende
reactie zouden oproepen van de cellen van het immuun systeem.
Het tweede vaccin maakte geen gebruik van plasmiden, maar van een
zogeheten adenovirus, dat als transportmiddel fungeerde voor een enkel hiv-gen. De gedachte
achter deze combinatie was dat het 'veilige' virus de aandacht van de immuuncellen moest
trekken en hen moest overhalen om hun afweerreacties tegen het hiv-eiwit te richten.
Een van ons (Weiner) werkte al acht jaar aan DNA-vaccins en hoopte nu overtuigend aan te
kunnen tonen dat het mogelijk is met behulp van plasmiden een mens immuun te maken voor een
gevreesde ziekteverwekker. Maar helaas brachten de testresultaten een gevoelige slag toe aan
degenen die hun hoop hadden gevestigd op deze eerste generatie DNA-vaccins. De DNA-vaccins
brachten maar een geringe -en soms zelfs geen enkele- afweerreactie tegen de vijf hiv-eiwitten
teweeg, terwijl het vaccin op basis van het adenovirus een krachtige reactie veroorzaakte.
Voor de universitaire onderzoekers en hun collega's van de farmaceutische industrie was het
een duidelijke zaak: de adenovirussen waren de beste kandidaten om mee verder te gaan bij de
ontwikkeling van een vaccin tegen hiv.
De tegenvallende testresultaten kwamen niet als een volslagen verrassing, want ook in eerdere tests waren zwakke immuunreacties gemeten. Toch waren we teleurgesteld, want we hadden goede redenen om te verwachten dat het plasmide-vaccin zowel veilig als effectief zou zijn. In de overtuiging dat het oorspronkelijke idee wel degelijk klopte, zetten de onderzoekers zich weer aan de tekentafel om een techniek te bedenken die tot een krachtigere afweerreactie zou leiden. En die inspanningen beginnen nu vruchten af te werpen.
Er is inmiddels een nieuwe generatie plasmidevaccins ontwikkeld die bij dierproeven en bij klinische tests op mensen de gewenste reacties teweegbrengen en tevens de andere voordelen hebben die DNA-vaccins zo aantrekkelijk maken, bijvoorbeeld dat ze veilig zijn. Deze DNA-technologie wordt nu ook toegepast voor andere vormen van immuuntherapie en om medicijnen rechtstreeks op de plaats van bestemming af te leveren. Het ziet ernaar uit dat deze op DNA gebaseerde vaccins en behandelingen een groot succes zullen worden, want ze zijn geschikt voor diverse ziekten waarvoor op dit moment nog geen effectieve behandeling bestaat.
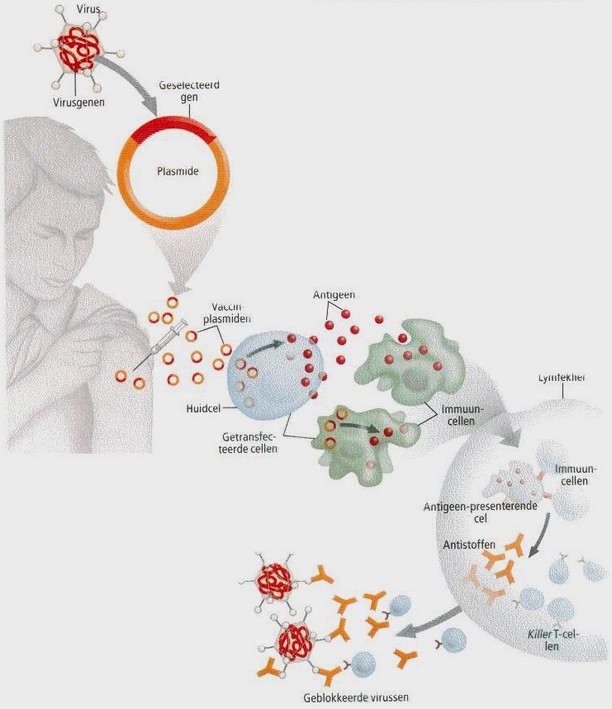
Toch een goed ideeBasisprincipeHOE WERKEN DNA-MEDICIJNEN?
Of ze nu bedoeld zijn om een ziekte te genezen of te voorkomen, in beide gevallen bestaan DNA-medicijnen uit plasmiden -minuscule cirkelvormige DNA-strengen- die zo zijn ontworpen dat ze een geselecteerd gen in het binnenste van een cel kunnen brengen. Zodra een plasmide binnen is, begint de cel het eiwit te produceren waarvoor het gen codeert.
In het geval van een antiviraal DNA-vaccin (zie afbeelding hieronder) brengen die viruseiwitten een immuunreactie teweeg die voorkomt dat het lichaam in de toekomst geÔnfecteerd wordt door dat specifieke virus.PRODUCTIE VAN DE VACCINEIWITTEN
Het via de huid toegediende DNA-vaccin dringt lokale huidcellen en enkele immuuncellen binnen, een proces dat transfectie wordt genoemd. De getransfecteerde cellen maken het door het plasmide geŽncodeerde viruseiwit, een zogeheten antigeen. Wanneer de antigeen-eiwitten de cellen verlaten, worden ze opgenomen door steeds meer immuuncellen.
REACTIE VAN DE IMMUUNCELLEN
De immuuncellen die een antigeen bij zich dragen, gaan naar de lymfeklieren. Daar ontstaan door interacties met andere immuuncellen antistoffen en killer T-cellen, die zo zijn afgesteld dat ze het viruseiwit herkennen en in de toekomst elk virus zullen aanvallen dat dat eiwit bevat.
Toen men in het begin van de jaren '90 serieus begon na te denken over de mogelijkheid
mensen te vaccineren met behulp van DNA, was meteen duidelijk dat dit in al zijn eenvoud een
elegant idee was. De plasmiden, die zodanig geconstrueerd zijn dat ze genen kunnen
transporteren die coderen voor een of meer eiwitten van een ziekteverwekker, zetten de cellen van de
ontvanger ertoe aan die eiwitten te produceren.
Zelf bevatten ze echter niet de instructies voor het maken van de gehele ziekteverwekker, dus
bestaat er geen risico dat het vaccin de ziekteverwekker zelf in het lichaam van de
gevaccineerde persoon brengt.
Wanneer de plasmiden een gastheercel binnengaan, een proces dat transfectie wordt genoemd, begint de machinerie die normaliter DNA decodeert het gen van de plasmide af te lezen en maakt het gewenste eiwit. Dat eiwit verlaat uiteindelijk de cel, ongeveer op dezelfde manier als virusdeeltjes zouden doen (zie illustratie hierboven). Eenmaal buiten de cel worden de eiwitten, die kenmerkend zijn voor de ziekteverwekker, door de immuuncellen herkend als lichaamsvreemde stoffen. Het immuunsysteem 'denkt' nu dat het lichaam is geÔnfecteerd en zal ook in de toekomst dit lichaamsvreemde eiwit herkennen en erop reageren. Door alleen maar een cirkelvormige streng DNA die ťťn gen bevat in het lichaam te brengen, kunnen we dus een immuniteit opwekken die beschermt tegen een complete ziekteverwekker.
DNA-vaccins zijn niet alleen simpel en veilig, ze hebben nog een aantal voordelen boven andere types vaccins.
Ze kunnen bijvoorbeeld aanzienlijk sneller geproduceerd worden dan sommige traditionele vaccins -zoals die tegen
griep- waarvoor 'levende' virussen gekweekt moeten worden. Daardoor neemt het productieproces minstens vier tot
zes maanden in beslag.
Verder is DNA inherent stabiel bij kamertemperatuur (anders zouden onze lichaamscellen niet
kunnen overleven), dus DNA-vaccins hoeven niet constant gekoeld te worden- een groot probleem bij het
vervoer en de opslag van veel vaccins, vooral in ontwikkelingslanden.
Vanuit het gezichtspunt van de ontwerpers van vaccins heeft DNA nog een ander pluspunt
dat er de afgelopen jaren toe heeft bijgedragen dat men opnieuw met deze technologie aan de
slag is gegaan. Het immuunsysteem beschouwt de plasmiden niet als lichaamsvreemd materiaal
-per slot van rekening zijn ze gemaakt van DNA- dus strikt gesproken wekt het vaccin zelf
geen afweerreactie op. Alleen het eiwit waarvoor het gen van de plasmide codeert trekt
meteen de aandacht van de patrouillerende immuuncellen.
Dat betekent dat een plasmide telkens opnieuw bij dezelfde ontvanger gebruikt
kan worden om allerlei verschillende genen af te leveren, zonder dat het risico bestaat dat het
lichaam immuniteit ontwikkelt tegen het DNA dat de genen vervoert en het vaccin zelf gaat
aanvallen.
Helaas waren de zwakke immuunreacties bij de eerste tests met DNA-vaccins een ernstige tegenvaller. De belangrijkste oorzaak was vermoedelijk dat de plasmiden niet in voldoende cellen doordrongen, en als ze wel wisten binnen te komen, produceerden de cellen niet genoeg van de geŽncodeerde eiwitten. Het gevolg was dat het immuunsysteem onvoldoende werd gestimuleerd.
De concurrerende methode -die gebruikmaakte van adenovirussen- zou uiteindelijk echter tegen een nog
groter probleem aanlopen.
In 2007 startte het farmaceutische bedrijf Merck een grootschalige test van een hiv-vaccin
dat een adenovirus met de naam AdHu5 gebruikte om genen van hiv te transporteren. Gezien de krachtige
immuunreacties die waren waargenomen bij eerdere experimenten met adenovirussen, waren de verwachtingen hoog
gespannen. In totaal kregen meer dan 1.800 hiv-negatieve proefpersonen het vaccin of een
placebo toegediend bij deze klinische test, die bekendstaat als de STEP-test.
Naarmate de test vorderde, begon zich echter een verontrustend verschil tussen de beide
groepen proefpersonen af te tekenen: de mensen die het vaccin kregen bleken niet beter tegen hiv
beschermd dan degenen die de placebo kregen, en uiteindelijk leken ze zelfs extra vatbaar te
worden voor hiv-infecties.
Van de 914 mensen in de vaccingroep werden er 49 hiv-positief en
van de 922 in de placebogroep slechts 33.
Toen dit effect duidelijk werd, werd de STEP-test in de zomer van 2009 voortijdig stopgezet.
Wat er precies is misgegaan wordt nog onderzocht, maar veel wijst erop dat het adenovirus de
voornaamste boosdoener was. Bij mensen die al immuun waren voor AdHu5, een virus voor een
gewone verkoudheid, heeft het immuunsysteem vermoedelijk het virus zelf aangevallen.
Waarom sommige proefpersonen vatbaarder leken te worden voor hiv, is nog onduidelijk.
Comeback
In de jaren voor het STEP-onderzoek hadden onderzoekers die nog in de DNA-methode geloofden
ijverig geprobeerd oplossingen te bedenken voor de complexe problemen die de eerste generatie
plasmidevaccins teisterden. Daarbij richtten ze zich op alle aspecten van de
activiteit van de plasmiden: ze zochten nieuwe manieren om de plasmiden in de cellen te krijgen,
nieuwe methoden om de eiwitproductie te vergroten wanneer ze eenmaal binnen waren en
toevoegingen die de reactie van het immuunsysteem op de eiwitten moesten versterken.
Tot de belangrijkste verbeterÓngen die dit onderzoek heeft opgeleverd behoren nieuwe methoden om
het vaccin op de plaats van bestemming te krijgen, want daardoor nemen veel
meer cellen -waaronder de immuuncellen zelf- de plasmiden op. De plasmiden kunnen bijvoorbeeld
in de huid worden toegediend, waar zich grote aantallen zogeheten antigeen-presenterende cellen bevinden,
met behulp van transdermale pleisters of andere naaldloze systemen als Gene Gun en Bioject die vaccins injecteren
met behulp van perslucht.
Deze methoden persen de plasmiden ook fysiek in meer cellen dan een traditionele injectie. Om een vergelijkbaar
resultaat te bereiken wanneer een vaccin gewoon met een naald in de huid of een spier
wordt geÔnjecteerd, kan men na de injectie elektroporatie toepassen, een reeks elektrische
pulsen die maken dat poriŽn in het celmembraan zich tijdelijk openen, zodat de plasmiden gemakkelijker
binnen kunnen dringen. Elektroporatie kan de plasmide-opname door een cel wel met een factor duizend vergroten.
VorderingenZORGEN DAT HET DNA AANSLAAT
Dankzij technieken die de effectiviteit van vaccins en behandelmethoden op basis van DNA vergroten, is er nu nieuwe hoop dat de DNA-aanpak een succes zal worden. Deze verbeteringen zorgen ervoor dat de plasmiden beter door de cellen worden opgenomen, dat de cellen vervolgens meer door de plasmiden geŽncodeerde eiwitten produceren en dat het immuunsysteem krachtiger op deze eiwitten reageert.
VERBETERDE OPNAME
Het vaccin wordt met een naaldloos injectiesysteem in de huid toegediend, waar veel immuuncellen zitten. Een dergelijk injectiesysteem perst meer plasmiden rechtstreeks in de huid- en immuuncellen dan een traditionele injectiespuit.
Als de plasmiden met een gewone injectienaald worden ingebracht, kan de opname door de cellen worden verbeterd met behulp van een zwakke elektrische stimulatie, de zogeheten elektroporatie. De elektrische pulsen zetten de cellen ertoe aan korte tijd poriŽn te openen waardoor de plasmiden kunnen binnendringen.
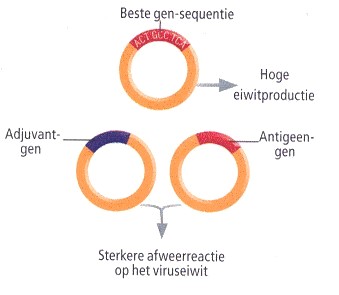
VERBETERD ONTWERP VAN DE PLASMIDEN
De instructies voor het maken van het eiwit waarvoor het plasmide-gen codeert, kunnen worden 'geschreven' met verschillende reeksen DNA-'letters', maar door bepaalde sequenties te selecteren, kunnen we de hoeveelheid eiwitten die een cel produceert vergroten.
BETERE STIMULERING VAN HET IMMUUNSYSTEEM De plasmide-genen kunnen ook coderen voor stoffen die cellen stimuleren, de zogeheten adjuvanten. Als er tegelijk met de antigenen ook adjuvanten worden geproduceerd, reageert het immuunsysteem krachtiger op het viruseiwit.
Het beste synoniem
De vaccins zelf zijn ook verbeterd door allerlei verfijningen van de DNA-sequenties van de
genen die de plasmide met zich meedraagt. Een van die verfijningen is de codon-optimalisatie,
waarbij de instructies van het gen zodanig worden 'geschreven' dat de cel ze gemakkelijker kan
uitvoeren. Een codon is een combinatie van drie DNA-'letters' die codeert voor een van de
aminozuren waaruit een eiwit is opgebouwd.
Sommige aminozuren kunnen worden aangeduid met meer dan een codon, maar cellen hebben meestal een
voorkeur voor ťťn van die 'synonieme' codons en vertalen dat gemakkelijker dan de andere.
Door de beste codons te kiezen, kunnen we de productie van het gewenste eiwit dus verhogen.
Door andere aanpassingen van de gensequentie kunnen we ook de stabiliteit en
nauwkeurigheid vergroten van de transcriptie van boodschapper-RNA die de cel feitelijk
'leest' om het eiwit te maken, waardoor de aanmaak van eiwitten sneller verloopt.
Aan het begin van elk gen zit een stukje DNA dat de leader-sequentie heet en dat als eerste door
de cel wordt vertaald wanneer hij een eiwitmolecuul wil maken. Wanneer we de leader-sequentie
van een gen optimaliseren, worden de uiteindelijke eiwitmoleculen stabieler.
Sommige leader-sequenties kunnen zelfs aangeven dat een bepaald eiwit door de cel uitgescheiden moet worden.
Dat is een groot voordeel, want dan kunnen de immuuncellen de lichaamsvreemde eiwitten zowel
binnen als buiten de getransfecteerde cellen tegenkomen. Die twee situaties leiden tot enigszins
verschillende afweerreacties, en de combinatie van die twee types reacties versterkt de algehele
immuniteit die het vaccin teweegbrengt.
Een laatste belangrijke verbetering heeft betrekking op de zogeheten adjuvanten, hulpstoffen die
meestal aan traditionele vaccins worden toegevoegd om sterkere reacties van het
immuunsysteem op te wekken. In sommige gevallen kan een adjuvant zelfs de reactie van het
immuunsysteem in een bepaalde richting sturen, zodat het bijvoorbeeld meer T-cellen gaat
produceren die geÔnfecteerde lichaamscellen opsporen en doden, in plaats van antistoffen die
proberen te verhinderen dat ziekteverwekkers de cel binnendringen.
Zo is van een chemische verbinding met de naam Vaxfectin aangetoond dat hij de antistoffenreactie op een DNA-vaccin tegen
influenza met een factor 200 versterkt.
Een andere adjuvant -Resiquimod- wordt in DNA-vaccins gebruikt om een krachtige immuunreactie op te wekken
waarbij zowel T-cellen als antistoffen worden geproduceerd.
De DNA-techniek heeft nog een ander belangrijk voordeel. Als een adjuvant achteraf aan
een kant-en-klaar vaccin wordt toegevoegd, kan dat problemen opleveren voor de emulgering of de
stabiliteit van de samenstelling. Maar met de nieuwe techniek kunnen de vaccinontwikkelaars het gen
dat codeert voor een adjuvantmolecuul direct in een plasmide integreren.
Cellen die de plasmide opnemen zullen dan zowel de geŽncodeerde adjuvant als de vaccineiwitten produceren.
Door genen voor adjuvanten toe te voegen aan een DNA-vaccin, kunnen we -zelfs als de plasmide al is geoptimaliseerd
zoals hierboven beschreven- de immuunreacties nog minstens vijf keer sterker maken.
Deze geavanceerde plasmidevaccins, die voor verschillende toepassingen op maat gemaakt kunnen worden, zijn
niet te vergelijken met de simpele, voor een eiwit coderende constructies waar de onderzoekers jaren geleden
mee begonnen. Dankzij de optimalisering van de plasmiden en de verbeterde methoden om het
gen op de plaats van bestemming te krijgen was de DNA-techniek klaar voor een comeback op
het moment dat het STEP-experiment begon.
Sterker nog: het ziet ernaar uit dat de DNA-aanpak ook heel geschikt is voor andere toepassingen dan
de klassieke vaccinatie, bijvoorbeeld om medicijnen met behulp van plasmiden op
een bepaalde plaats in het lichaam af te leveren of voor immunotherapieŽn tegen sommige
vormen van kanker.

Vele toepassingen
Nu het mogelijk is genen op een veilige manier in de cellen te brengen en die ertoe aan te zetten
op een efficiŽnte manier de geŽncodeerde eiwitten te produceren, komen tal van nieuwe potentiŽle
behandelmethoden binnen handbereik.
Het ziet er zelfs naar uit dat deze op DNA gebaseerde therapieŽn nog eerder een plaatsje in de
klinische praktijk zullen veroveren dan de DNA-vaccins. Anders dan conventionele medicijnen, die
vaak bestaan uit kleine chemische moleculen, brengen DNA-therapieŽn een gen
naar een bepaalde plaats van het lichaam om een kwaal te bestrijden. Maar in tegenstelling
tot de traditionele gentherapie wordt de plasmide niet blijvend in het celgenoom van de
ontvanger geÔntegreerd - het blijft zelfs niet permanent in de cel, waardoor complicaties vermeden
worden die in het verleden de vooruitgang op het gebied van de gentherapie hebben bemoeilijkt.
Zoals dat vaak gaat met nieuwe technieken, zijn de eerste successen met plasmidetherapieŽn geboekt bij dieren. Een van die therapieŽn, die al is goedgekeurd voor toepassing bij varkens, is bedoeld om miskramen te voorkomen. Wanneer het middel aan zwangere zeugen wordt toegediend in combinatie met elektroporatie, dringt de plasmide binnen in de lichaamscellen van de zeug, die vervolgens het hormoon GHRH (growth hormone-releasing hormone) aanmaken dat het overleven van de foetus bevordert. Een van de voordelen van deze behandeling is dat hij bij zo'n groot dier al na ťťn injectie aanslaat, wat een gunstig voorteken is voor toepassing bij mensen.
Er worden momenteel al verschillende grootschalige klinische tests bij mensen uitgevoerd (zie tabel hierboven) met de DNA-techniek. Bij een daarvan leveren de plasmiden genen af voor eiwitten die groeifactoren worden genoemd en die stamcellen mobiliseren om hartfalen te bestrijden.
Een andere test maakt gebruik van een plasmide die codeert voor een groeifactor met de naam IGF-1 om een groeistoornis te behandelen bij mensen die lijden aan de aangeboren immuunziekte SCID (severe combined immunodeficiency).
Een derde test richt zich op kritieke ischemie, een stoornis van de bloedsomloop die notoir moeilijk te behandelen is. De plasmiden coderen voor factoren die de groei van nieuwe bloedvaten bevorderen, en zo is misschien te voorkomen dat het getroffen lichaamsdeel moet worden geamputeerd.
Een ander type behandelingen, de biologische immunotherapie op basis van DNA, combineert de
sterke punten van een DNA-behandeling met die van een DNA-vaccin, door een
gen af te leveren dat het lichaam ertoe aanzet een afweerreactie op gang te brengen tegen een
al bestaande ziekte, bijvoorbeeld een tumor of een chronische virusinfectie. Zo is er een
klinische test begonnen waarbij men gebruikmaakt van DNA dat codeert voor viruseiwitten om de
immuuncellen ertoe aan te zetten tumoren aan te vallen die zijn veroorzaakt door het humaan
papillomavirus (HPV).
De eerste resultaten van deze test laten zien dat bij de helft van de proefpersonen de T-cellen
reageren op de HPV-eiwitten, en dat bij tachtig procent hoge concentraties antistoffen ontstaan.
In een andere klinische test wordt momenteel een vorm van immunotherapie met DNA uitgeprobeerd tegen
het hepatitis-C-virus. Dat de eerste resultaten van deze beide tests bemoedigend zijn is heel
belangrijk, want tot op heden bestaan er geen effectieve immunotherapieŽn tegen HPV-tumoren of
hepatitis-C.
Ook op dit gebied zijn veterinaire toepassingen al een stuk verder gevorderd dan die voor de
mens. Onderzoekers die kanker bij de mens bestuderen zijn erg opgetogen over een op DNA
gebaseerde therapie waarmee melanoom bij honden behandeld wordt. Het middel wordt geproduceerd
door het farmaceutische bedrijf Merial, en honden die ermee worden behandeld
overleven na de diagnose gemiddeld zes keer zo lang als niet behandelde honden.
Deze biologische immunotherapie op basis van DNA laat zien dat er een grote kans is dat de nieuwe
generatie DNA-therapieŽn zal slagen waar voorgaande pogingen hebben gefaald.
Hoop voor de toekomst
De afgelopen tien jaar zijn er tientallen klinische tests uitgevoerd met DNA-medicijnen en DNA-vaccins.
De voordelen van de DNA-aanpak zijn vooral duidelijk bij de plasmide-versies van griepvaccins.
Ons onderzoeksteam heeft een griepvaccin ontwikkeld dat momenteel bij mensen wordt getest, nadat was
gebleken dat het dieren beschermt tegen verschillende stammen van de 'gewone' griep, maar ook tegen de dodelijke
vogelgriep H5N1 die de afgelopen vijf jaar honderden mensen heeft geÔnfecteerd. Dat het vaccin
zo'n brede bescherming biedt, komt doordat de plasmiden zogeheten consensus-sequenties van
genen van griepvirussen bevatten.
De viruseiwitten waarvoor die genen coderen lijken op de eiwitten van een heleboel verschillende
griepstammen. Deze vaccins zouden een eind kunnen maken aan het probleem dat een griepprik soms niet
werkt tegen de specifieke griepstam die in een bepaald jaar de kop opsteekt.
De nieuwe griepstam HIN1, die verleden jaar opdook en een wereldwijde pandemie veroorzaakte, maakt nog eens duidelijk dat het hoog tijd wordt voor een nieuwe benadering van de vaccinkwestie. De traditionele methoden om vaccins te maken dreigden te kort te schieten toen erin de loop van de zomermaanden plotseling grote hoeveelheden geproduceerd moesten worden. Daarentegen slaagde het farmaceutische bedrijf Vical er in mei 2009 in binnen twee weken een experimentele DNA-versie van een H1N1-vaccin te maken. Als zo'n vaccin al getest en goedgekeurd was geweest, had het minstens twee maanden eerder in grote hoeveelheden ge- produceerd kunnen worden dan de standaardvaccins. Het vaccin van Vical verkeert momenteel in de eerste fase van klinische tests en de resultaten zijn hoopgevend.
Omdat het ernaar uitziet dat DNA-vaccins en DNA-therapieŽn ziekten kunnen bestrijden waartegen geen andere remedie bestaat, is de DNA-benadering ook terug in de race om een vaccin tegen hiv te ontwikkelen. Een vaccin dat momenteel klinisch wordt getest, Pennvax-B, bevat drie genen van het hiv-virus en een aantal genen die coderen voor adjuvantmoleculen. Het wordt toegediend in combinatie met elektroporatie.
Twee andere vaccins worden getest met een strategie die inhoudt dat plasmiden eerst de
immuuncellen 'leren' de hiv-eiwitten te herkennen, waarna er een ander type vaccin wordt
toegediend dat de eerste afweerreactie versterkt.
Een van deze vaccins, GeoVax, wordt gecombineerd met het MVA-vaccin (modified vaccinia Ankara)
om de immuunreactie te versterken. En de ironie wil dat het Vaccine Research Center van
het Amerikaanse Instituut voor Volksgezondheid momenteel een ander op DNA gebaseerd
hiv-vaccin test waarbij de immuunreactie wordt versterkt door twee hiv-vaccins op basis van
adenovirussen - de aanvankelijke concurrenten van de DNA-aanpak.
Uit het feit dat verscheidene DNA-vaccins al worden toegepast bij dieren en in een gevorderd stadium verkeren van klinische tests bij mensen voor ziekten die tot op heden moeilijk te behandelen zijn, blijkt wel hoever de plasmide-techniek al is voortgeschreden. Dankzij indrukwekkende vorderingen op dit terrein zijn er de afgelopen tien jaar de meest creatieve vaccins en therapieŽn ontwikkeld die ooit zijn getest voor de behandeling van mensen. Het is dan ook begrijpelijk dat de onderzoekers die zich met grote inzet over deze technologie hebben ontfermd toen ze nog in de kinderschoenen stond, een zekere trots voelen nu ze zien dat ze, na een moeilijke jeugd, een schitterende toekomst tegemoet gaat.
waar nog geen behandeling voor bestaat
Matthew P. Morrow en David B. Weiner werken beiden aan de Universiteit
van Pennsylvania.
Morrow doet als postdoctoraal onderzoeker al bijna
tien jaar onderzoek aan het hiv-virus en houdt zich tegenwoordig vooral
bezig met vaccins en immunotherapieŽn op basis van DNA.
Weiner is hoogleraar pathologie en geneeskunde en geeft leiding aan het
onderzoeksprogramma "Gentherapie en Vaccins" van de universiteit. Hij is
een pionier op het gebied van DNA-vaccins en heeft als eerste klinische
tests uitgevoerd met vaccins op basis van plasmiden. Verder werkt hij als
adviseur voor de FDA en voor tal van bedrijven die vaccins en medicijnen op
basis van plasmiden proberen te ontwikkelen.
Veel dodelijke slachtoffers van ongelukken overlijden niet aan de opgelopen verwondingen, maar aan later optredende ontstekingsreacties. Als die uit de hand lopen, kunnen ze alle organen uitschakelen. Vaak is er geen bacterie in het spel. Het overkomt mensen met een botbreuk zonder uitwendige verwondingen.
Volgens onderzoekers uit Boston spelen mitochondriŽn die uit dode cellen vrijkomen hierbij een rol. Omdat mitochondriŽn, de energiecentrales van cellen, in bepaalde opzichten op bacteriŽn lijken, worden ze door cellen van het immuunsysteem abusievelijk daarvoor aangezien (Nature, 4 maart).
Of die ontstekingen nu worden veroorzaakt door bacteriŽn of iets anders, de symptomen zijn dezelfde: koorts, een verhoogde hartslag, een dalende bloeddruk en een snel om zich heen grijpende ontstekingsreactie. Bij bacteriŽle infecties spreekt men van bloedvergiftiging of sepsis. De ontstekingen worden daarbij veroorzaakt door neutrofiele cellen van het immuunsysteem. Deze herkennen het DNA en bepaalde eiwitten die veel bacteriŽn gemeenschappelijk hebben en trekken ertegen ten strijde door ontstekingsreacties op gang te brengen.
Hoe dezelfde symptomen kunnen ontstaan zonder dat er sprake is van een bacteriŽle infectie was lang volstrekt duister. Het idee dat de mitochondriŽn uit beschadigde cellen een rol zouden kunnen spelen, is minder vreemd dan het lijkt. Aangenomen wordt dat deze energiefabriekjes van de cel -in iedere cel zitten er 100 tot 1.000- het overblijfsel zijn van een in de loop van de evolutie ontstane symbiose tussen een bacterie en een grotere, kernhoudende cel. De resten ervan zijn zichtbaar: mitochondriŽn hebben nog eigen, circulaire DNA-moleculen en eiwitten die soms sterk op die van bacteriŽn lijken.
De onderzoekers toonden aan dat in het bloed van traumapatiŽnten zonder open wonden veel meer mitochondriaal DNA voorkomt. En dat zowel het mitochondriale DNA als de eiwitten de neutrofiele cellen op dezelfde manier activeren tot ontstekingsreacties als hun bacteriŽle evenknieŽn. De onderzoekers hopen dat hun werk zal bijdragen aan een effectievere behandeling van ernstig gewonde patiŽnten.
Huup Dassen
Ons afweersysteem kan sterk op een infectie reageren doordat afweercellen die het virus herkennen snel gaan doelen. De kracht van die reactie wordt dus niet bepaald door de efficiŽntie waarmee de juiste afweercellen dat virus vinden. Die T-cellen blijken dat contact mer een virus dat ze kunnen bestrijden, zeer efficiŽnt te leggen. Onderzoekers van het Nederlands Kanker Instituut halen daarmee, samen met buitenlandse collega's, een oude theorie binnen de immunologie onderuit (Science, 4 september).
De resultaten van het onderzoek zijn belangrijk omdat de herkennings- en groeimechanis men van T-cellen de basis
van vaccinatie vormen. Bij het vaccinonderzoek wordt vaak geprobeerd om de herkenning door T -cellen te verbeteren.
Maar dit onderzoek wijst uit dat die al erg efficiŽnt is. Vaccinonderzoekers kunnen zich daarom waarschijnlijk
beter op de vermenigvuldiging van T-cellen richten.
T-cellen zijn cellen van het afweersysteem die in bloed en lymfe zitten. Ze herkennen lichaamsvreemde moleculen en ruimen vervolgens de lichaamscellen op waar die in zitten.

|
Er kunnen ontzettend veel verschillende lichaamsvreemde eiwitten in het lichaam komen, afkomstig van virussen, bacteriŽn en schimmels, en allemaal worden ze bestreden. Ieder mens heeft daarvoor vanaf de geboorte 200 miljard verschillende T-cellen. Van iedere T-cel wordt kort na de geboorte getest of hij niet per ongeluk lichaamseigen moleculen aanvalt. Als ze dit wel doen, worden ze opgeruimd.
Bij iemand die nog niet eerder aan een bepaald virus is blootgesteld, herkent maar ťťn op de honderdduizend T-cellen dat virus. De juiste T-cel moet het lichaamsvreemde molecuul dus maar net tegenkomen, daarom werd jarenlang gedacht dat de herkenning van het virus de snelheid en intensiteit van de afweerreactie bepaalt.
Om een virus te kunnen vernietigen moet de T-cel zich na de herkenning van het virus snel gaan delen. Nadat een T-cel zich aan de geÔnfecteerde cel heeft gebonden, komen er moleculen vrij die de cel doden -met het binnengedrongen virus.
De onderzoekers vergeleken de reacties van het immuunsysteem bij verschillende virussen
en verschillende maten van infectie met elkaar. De herkenning van het virus bleek erg efficiŽnt
te verlopen omdat het aantal T-cellen dat wordt geactiveerd nagenoeg constant bleef.
De toename van T-cellen na de herkenning bleek juist wel te verschillen.
Djoke Hendriks
Een nieuw antiviraal medicijn breekt radicaal met de oude aanpak van virusziekte die direct tegen de virusdeeltjes zijn gericht. De uitvinders denken dat het middel tegen een groot aantal verschillende virussen werkt. Bovendien kunnen de ziekteverwekkers er niet resistent tegen worden, aldus de ontwikkelaars van de universiteit van Texas en het bedrijf Peregrine Pharmaceuticals (Nature medicine, online 23 november).
 | Fosfatidylserine (geel) ligt normaal
alleen binnenin het celmembraan. Door een infectie floept het naar buiten en is bruikbaar als 'vlag' om geÔnfecteerde cellen te laten vernietigen. PEREGRINE PHARMACEUTICALS |
Virussen kunnen resistent worden tegen medicijnen die een onderdeel van hun structuur of stofwisseling blokkeert. Door mutaties veranderen virussen voortdurend hun structuur, of omzeilen de geblokkeerde stap in hun stofwisseling, zodat er resistente stammen ontstaan.
Het nieuwe medicijn valt echter niet het virus zelf aan. Het markeert cellen die door het virus
zijn geÔnfecteerd. Die cellen worden vervolgens door het afweersysteem vernietigd, inclu-
sief aanwezige en ontsnapte virusdeeltjes.
Het is allemaal gebaseerd op een verandering die een celmembraan ondergaat als een
virus de cel infecteert. Zo'n membraan bestaat uit twee lagen lipiden. Dat zijn vetachtige
moleculen waarvan veel verschillende soorten in het membraan voorkomen.
Eťn van die lipiden, fosfatidylserine, zit normaal gesproken alleen in de
binnenste laag. Bij een cel die door een virus is geÔnfecteerd,
verschijnt fosfatidylserine echter ook aan de buitenkant.
Het nieuwe middel, bavituximab, is een antistof die aan fosfatidylserine bindt, waarop het immuunsysteem reageert en de cel vernietigt.
De onderzoekers hebben het middel nog niet uitgebreid bij mensen getest. Wel
bij cavia's en muizen. De cavia's kregen een dodelijk hoeveelheid Pichinde-virus ingespoten.
De helft van de dieren genas na een injectie van bavituximab.
Dieren die een nepmiddel kregen, gingen allemaal dood.
Het Pinchide-virus veroorzaakt hoge koorts en bloedingen en is door het Pentagon op de lijst van mogelijke bioterroristische wapens gezet.
Bavituximab bleek muizen te beschermen tegen het cytomegalovirus, waar transplantatie-
en aidspatiŽnten vaak mee kampen.
Bavituximab wordt momenteel getest bij patiŽnten met hepatitis C. Het lijkt veilig
te zijn en de hoeveelheid virus in het bloed loopt duidelijk terug.
Huup Dassen
Nienke van Trommel in NRC 5 juni 2004, p. 47.
Muizen krijgen een auto-immuunziekte als het gen voor het signaaleiwit MFG-E8 is uitgeschakeld. Hun afweersysteem vernietigt dan hun eigen weefsel. De muizen waarin het gen is uitgeschakeld kunnen een belangrijk model worden voor onderzoek naar levensbedreigende auto-imuunziekten, zoals systemische lupus erythomatosus (SLE).
De oorzaak van de auto-immuunziekte bij de muizen zit in de macrofagen die stervende cellen opruimen. Zonder MFG- E8 verliezen de macrofagen hun eetlust. De stervende cellen lekken daardoor erfelijk materiaal uit hun celkern. En dat materiaal zorgt voor een heftige afweerreactie die zich tegen eigen weefsel richt (Science, 21 mei 2004).
Stervende of apoptotische cellen geven een signaal af aan het afweersysteem dat ze moeten worden opgeruimd: het eiwit PS (fosfatidylserine) dat normaal aan de binnenzijde van het celmembraan zit, gaat aan de buitenkant zitten. In de reageerbuis was aangetoond dat MFG-E8 (milk fat globule epidermal growth factor 8) een verbinding vormt tussen PS op de stervende cel en een gespecialiseerde macrofaag. Na de binding omhult de macrofaag de cel en breekt hem af.
Japanse onderzoekers hebben bij muizen het gen voor MFG-E8 uitgeschakeld. De dieren kregen binnen 40 weken na
hun geboorte een auto-immuunziekte. Vooral de afweer tegen materiaal uit de celkern nam snel toe, tot wel
het duizendvoudige vergeleken met normale muizen.
Bij analyse zagen de onderzoekers dat de macrofagen nog wel aan stervende cellen binden, maar dat opeten niet lukt.
In gezonde muizen verorbert een macrofaag gemiddeld 1,2 apoptotische cellen. In de MFG-E8-loze muizen verschalkte
ťťn macrofaag maar gemiddeld 0,3 apoptotische cellen. Zodra kunstmatig MFG-E8 werd toegevoegd, namen de macrofagen
de stervende cellen beter op, bijna evenveel als bij de macrofagen van normale muizen.
Tenslotte toonden de onderzoekers met kleurstof en elektronenmicroscopie aan dat macrofagen van muizen
zonder MFG-E8, celkernen van gestorven cellen op hun celoppervlak droegen, maar ze niet vernietigden.
Een gevolg van auto-immuunziekten is dat eiwitcomplexen van de afweeropwekkende stof, gekoppeld aan eiwitten
van afweercellen (antilichamen) door hun omvang in de nieren blijven steken en daar een chronische ontsteking
veroorzaken. Het gevolg is eiwitverlies uit de nieren. Acht van de tien muizen zonder MFG-E8, leden aan een dergelijk
eiwitverlies in de urine. De onderzoekers verwachten dat er met hun muizenmodel nog veel onderzoek gedaan kan
worden naar de rol en het mechanisme van het opruimen van apoptotische cellen.
John J.L. Jacobs; Tumor immunologie: je afweersysteem vecht tegen kanker. Mens & Wetenschap, jrg. 30, dec. 2003, p. 421-425.
Ongeneeslijk zieke kankerpatiŽnten genezen soms 'spontaan'.
Niet zelden begint de genezing na een zware infectie. Aangezien een infectie het afweersysteem
stimuleert, werd de suggestie geopperd dat het afweersysteem op eigen kracht een kankergezwel
kan opruimen. In de eerste experimenten met proefdieren werden bacteriŽn gebruikt om het
afweersysteem te activeren. Soms bleek deze aanpak succesvol bij de bestrijding van
'ongeneeslijke' tumoren. Sindsdien wordt, met wisselend succes, het afweersysteem gestimuleerd
om tumoren te laten verdwijnen.
Huidige anti-kanker therapie
Een goedaardig kankergezwel groeit niet hard en blijft beperkt tot het weefsel waarin het groeit.
Goedaardige gezwellen worden meestal operatief verwijderd.
Kwaadaardige tumoren kunnen echter ook nog uitzaaiingen (metastasen) veroorzaken. Dit zijn
losgeraakte 'op hol geslagen' cellen die zich op een andere plek in het lichaam kunnen nestelen
en daar gaan woekeren. In dat geval, kan vaak alleen de oorspronkelijke tumor worden verwijderd,
maar niet de uitzaaiingen. Echter, de uitzaaiingen zijn meestal de belangrijkste oorzaak van de
dood van de patiŽnt. Het behandelen van uitzaaiingen is moeilijk, omdat ze vaak op vele plaatsen
in het lichaam verdeeld zitten. Hierdoor is het onmogelijk ze via een operatie te verwijderen.
Een ideale therapie valt alleen kankercellen aan en laat de gezonde lichaamscellen met rust. Bestaande therapieŽn als chemotherapie en bestraling doden inderdaad de snel delende tumorcellen. Maar helaas delen ook vele lichaamscellen zich snel, waaronder die van de darmen, huid, haren en de bloedvormende cellen uit het beenmerg. Het aspecifieke doden van normale cellen door deze therapieŽn zorgt voor bijwerkingen zoals haaruitval, schraalheid van de huid en onderdrukking van het afweersysteem. Omdat deze bijwerkingen dodelijk kunnen zijn voor de patiŽnt kan de huidige anti-kanker therapie niet met volle kracht worden ingezet.
De kracht van het afweersysteem.
Bij sterfte van de patiŽnt is de tumor in gewicht vaak 1 - 2 % van het lichaamsgewicht. Orgaantransplantaties hebben laten zien dat het afweersysteem hele organen (nier, hart, etc.) kan afstoten. De snelheid van afstoting is verschillend, soms in een tijdsbestek van uren, maar als de reactie minder fel is kan het ook dagen, weken, maanden of jaren duren.
De tumoren in de kliniek die onbehandelbaar zijn voor standaard anti-kanker therapie zijn ongeveer even groot als bovengenoemde getransplanteerde organen die door het afweersysteem kunnen worden vernietigd. De kracht van het afweersysteem zou dus in theorie voldoende moeten zijn om een gezwel op te ruimen. Aangezien het afweersysteem door het hele lichaam werkt kunnen op deze manier ook de uitzaaiingen door het hele lichaam worden opgeruimd. Maar dat het niet zo eenvoudig werkt komt verderop aan bod.
Kan een tumor worden aangevallen door het afweersysteem?
Tumoren, en met name de kwaadaardige, verschillen in nogal wat eigenschappen van normaal weefsel. De meeste tumoren maken eiwitten die je niet in normale cellen verwacht, niet zelden zijn het eiwitten die alleen in embryonale cellen voorkomen. Ook kunnen eiwitten veranderd zijn door mutaties in de genen. Andere eiwitten functioneren als tumor antigenen, deze speciale eiwitten worden dus door het afweersysteem herkend als 'tumor-eiwitten'.
Het woord antigeen is een samenstelling van antistof-genererend. Een antigeen is
dus een stofje waarop het afweersysteem kan reageren door het maken van een antistof
gericht tegen het antigeen.
Aanvallen gericht op bepaalde (veranderde) eiwitten gebeuren door het specifieke deel
van het afweersysteem. Een ander deel van de afweer tegen tumoren is de natuurlijke afweer.
Sommige eiwitten die belangrijk zijn voor de normale functie en bescherming van de cel zijn soms
niet aanwezig in tumorcellen. Hierdoor zijn kankercellen vaak kwetsbaarder voor aanvallen van
het afweersysteem. Nog een verschil tussen normaal weefsel en tumorweefsel zit hem in de
bloedvaten. Omdat een tumor snel groeit zijn de bloedvaten in het gezwel vaak jong,
en niet zelden ook nog anders dan normale bloedvaten in het weefsel.
Tenslotte is ook het weefsel rond de cellen (de extracellulaire matrix) in tumoren anders dan in gewoon weefsel. Al deze verschillen tussen normaal weefsel en tumor weefsel maakt dat het afweersysteem gericht actie kan ondernemen tegen de tumor. Hierbij speelt de samenwerking tussen natuurlijke en specifieke afweer een grote rol. De natuurlijke afweer kan zorgen dat specifieke afweer ontstaat. De specifieke afweer op zijn beurt kan de natuurlijke afweer stimuleren.
Afweer van nature
Het afweersysteem kent twee hoofdprincipes: de natuurlijke afweer en
de specifieke afweer. Natuurlijke afweer is altijd aanwezig, maar kan worden
versterkt en worden ingezet door de specifieke afweer.
- De specifieke afweer ontstaat pas na blootstelling aan de vreemde 'stof'.
Een voorbeeld van specifieke afweer is de immuniteit tegen kinderziektes zoals de waterpokken.
- De natuurlijke afweer begint bij de barriŤre met de buitenwereld (1e afweerlinie),
zoals de huid, slijmvliezen en lysozyme (enzym dat bacterie ten gronde richt) in zweet en
traanvocht.
Kanker ontstaat echter door verlies van regulatie van celgroei in de eigen lichaamscellen.
De woekering begint van binnenuit, dus de 1e afweerlinie wordt omzeild.
In vrijwel alle weefsels en organen van het lichaam bevinden zich macrofagen en
dendritische cellen. Beide cellen komen het weefsel binnen als monocyten vanuit
het bloed en vinden hun oorsprong in het beenmerg. Beide cellen hebben uitlopers, die met name
bij de dendritische cel lijken op de dendrieten van zenuwcellen.
Zowel macrofagen als dendritische cellen spelen een rol binnen het afweersysteem,
maar met een totaal verschillende taak. Daarom worden ze tegenwoordig als twee totaal
verschillende celpopulaties gezien.
Dendritische cellen (1) spelen een cruciale rol bij het ontstaan van specifieke immuniteit
(daarover is verderop meer te lezen).
Macrofagen (2) ruimen onder normale omstandigheden weefselafval, zoals dode cellen op. Bij een
ontsteking kunnen macrofagen geactiveerd worden door bacteriŽn en/of door het specifieke
afweersysteem. Geactiveerde macrofagen kunnen bacteriŽn doden en mits voldoende sterk geactiveerd
ook cellen. Ook neutrofiele granulocyten kunnen op deze manier worden geactiveerd om
bacteriŽn en eventueel cellen te doden. De neutrofielen bevinden zich normaal in de
bloedcirculatie, maar worden in geval van ontsteking razendsnel gerekruteerd.
Een derde celtype (3) zijn de natural killer (NK) cellen. NK-cellen kunnen van nature virusgeÔnfecteerde cellen en sommige kankercellen doden. De meeste gezwellen die ontstaan zijn echter ongevoelig voor niet-geactiveerde NK-cellen. Het specifieke afweersysteem kan NK-cellen activeren tot een sterkere activiteit tegen kankercellen.
Specifieke afweer en immuniteit
Drie verschillende typen lymfocyten zijn verantwoordelijk voor de specifieke afweer,
te weten B-cellen, Helper T cellen en celdodende (cytotoxische) T-cellen.
B-cellen produceren antistoffen,
celdodende T-cellen doden specifiek cellen die ze herkennen en
Helper T-cellen zorgen voor de sturing van de afweer.
Zoals alle cellen van het afweersysteem komen ook lymfocyten oorspronkelijk uit het beenmerg.
Maar lymfocyten hebben ook een unieke eigenschap: elke lymfocyt heeft een andere specifieke
receptor waarmee die een bepaald eiwit herkent.
Met z'n allen kunnen ze vrijwel alle mogelijke eiwitten herkennen. Om te voorkomen dat lymfocyten
eiwitten van het eigen lichaam herkennen en daar op gaan reageren, worden die lymfocyten eruit
geselecteerd. Voor B-cellen gebeurt dat in het beenmerg, voor de beide type T-cellen in
de thymus, een klein afweerorgaantje, dicht bij het hart gelegen. Hierdoor heeft iedereen
dus een grote groep lymfocyten die elk binden aan ťťn lichaamsvreemd eiwit, maar allemaal tezamen
reageren ze met alle mogelijke lichaamsvreemde eiwitten.
Het ontstaan van specifieke afweer
Specifieke afweer wordt opgewekt door en is gericht tegen lichaamsvreemde eiwitten die
aanwezig zijn in het weefsel. Na opname van deze eiwitten, gaan de dendritische cellen via
afvoerende lymfe uit het weefsel, naar de lymfeknoop. Daar presenteren de
dendritische cellen op verschillende manieren de eiwitten aan de verschillende lymfocyt-typen.
De dendritische cellen laten de lymfocyten niet alleen de eiwitten uit het weefsel zien, maar
geven ook nog extra informatie. Die extra informatie is bedoeld om de afweerreactie te sturen,
en heet co-stimulatie.
De belangrijkste co-stimulatie wordt opgewekt als het weefsel 'gevaar' loopt.
Gevaar kan iets zijn waarvan het lichaam weet dat het gevaarlijk is, zoals verschillende typen bacteriŽn en gisten. Op de buitenkant van bacteriŽn en gisten zitten bepaalde suikerverbindingen die weer op bepaalde eiwitten geplakt zitten. Het immuunsysteem kan deze vreemde suikerverbindingen onderscheiden van de lichaamseigen suikerverbindingen. Want alle eiwitten aan de buitenkant van de cellen van de mens zijn voorzien zijn van zeer specifieke suiker-structuren. Ook stress-eiwitten (heat shock proteins) kunnen duiden op gevaar, zij komen vrij als cellen zich niet zo lekker voelen (bijvoorbeeld bij zuurstoftekort) of als de cellen dood gaan.
Behalve dat de dendritische cel met co-stimulatie vertelt dat er gevaar is, vertelt deze ook
wat voor soort gevaar het is, en hoe het afweersysteem moet reageren. De co-stimulatie door
de dendritische cel kan de afweerreactie sturen doordat een bepaald type helper T-cellen
ontstaat, type 1 of 2.
Type 1 helper T-(Th1)cellen stimuleren de aanmaak van celdodende T-cellen (zie
ook afbeelding 2).
Type 2 helper T-(Th2)cellen stimuleren de aanmaak van antistoffen door B-cellen.
Indien co-stimulatie niet aanwezig is, dan stimuleren de dendritische cellen het ontstaan van
regulerende T-cellen (Tr1).
De Tr1-cellen zorgen op hun beurt dan weer voor suppressor T-(Ts)cellen.
Deze Ts en Tr1 cellen beschermen het weefsel door de afweerreactie te onderdrukken.
Deze onderdrukking van het afweersysteem noemen we actieve tolerantie.
De Th1, Th2 of Tr1 cellen die gevormd zijn blijven aanwezig om de afweerreactie te sturen
in 'hun' richting, en remmen elkaars activiteit. Dus als de afweerreactie ťťnmaal een
bepaalde 'keuze' heeft gemaakt wordt het moeilijker om van keuze te veranderen.
Cytokines in de afweer
Cytokines zijn kleine eiwitten die door de cellen van het afweersysteem veel worden gebruikt
om met elkaar te communiceren (zie afbeelding 1).
De meeste cytokines kennen vele verschillende activiteiten, mede afhankelijk van de cel
die het cytokine opvangt. Bij de hierboven vermelde Th1, Th2 en Tr1 cellen horen bepaalde
groepen cytokines. Aanwezigheid van die cytokines stimuleert hun eigen type afweerreactie.
Is een bepaalde groep cytokines aanwezig dan stimuleert deze ook een bepaalde afweerreactie.
De cytokines remmen meestal andere typen afweerreacties.
Interleukine 12 (IL-12) en interferon-lambda horen bij Th1 reacties.
IL-4 en IL-5 bij Th2 reacties.
IL-2 vooral bij Th1, maar ook bij Th2.
IL-10 en Transforming Growth Factor-bŤta (TGF-bŤta) horen bij de Tr1 respons van actieve
tolerantie. Dit is ook een van de oorzaken waarom TGF-bŤta, zoals de naam al zegt,
(transforming) kanker groei bevordert.
Th2 cytokines IL-4 en IL-5 zijn bijvoorbeeld betrokken bij allergisch astma en de productie
van antistoffen.
IL-12 kan bloedvaten doden, en zowel IL-12 als interferon-lambda kunnen macrofagen aanzetten
tot het doden van cellen.
IL-2 stimuleert alle type T-cellen, NK-cellen en kan leiden tot bloedvatlekkage.
 |
Afb. 1: Sturen van het afweersysteem door cytokines: De dendritische cel (DC) neemt antigenen op, bijvoorbeeld van een tumor. Vervolgens kan deze op drie manieren het afweersysteem aanzetten. Hoe het afweersysteem wordt aangezet is afhankelijk van het cytokine milieu. Interleukine 12 (IL-12) en interferon-lambda zetten aan tot type 1 immuniteit. IL-4 en IL-5 zetten aan tot type 2 immuniteit. IL-2 en TNF-alfa stimuleren zowel type 1 als type 2 immuniteit. IL-10 en Transforming Growth Factor bŤta (TGF-&beta) zorgen voor type r1, dat de afweerreactie onderdrukt (actieve tolerantie). Behalve dat cytokines een bepaald type afweerreactie kunnen aanzetten (aangegeven met de doorgetrokken pijlen) zullen die cytokines andere type afweerreactie remmen (aangegeven met stippellijnen in omgekeerde richting). |
Immuniteit tegen kanker
In de inleiding werd verteld dat ongeneeslijk zieke kankerpatiŽnten soms 'spontaan' genezen, na het doormaken van een infectie. Het nabootsen van een infectie, door het toedienen van dode bacteriŽn kan soms ook patiŽnten doen genezen. Bij deze patiŽnten word gekeken of ze een afweerreactie tegen de tumor hebben. Sommige van deze patiŽnten hebben bijvoorbeeld B-cellen die antistoffen maken tegen de (antigenen van) de tumor. Anderen hebben T-cellen specifiek tegen de tumor reageren. Sommige zowel T als B-cellen.
Celdodende T-cellen kunnen antigenen op tumorcellen herkennen en deze dan direct doden.
Helper T-cellen kunnen tumoren indirect herkennen via antigeen presenterende cellen
(de dendritische cellen), die in alle organen van het lichaam en zich meestal ook in en anders
rond tumoren bevinden.
Na herkenning van de tumor maken helper T-cellen cytokines die andere (afweer-)cellen stimuleren
in hun functies.
- Afhankelijk van het cytokine kunnen B-cellen worden gestimuleerd om antistoffen te maken,
- celdodende T-cellen worden gestimuleerd om tumoren te doden, of
- andere cellen worden gestimuleerd om de tumor of zijn bloedvaten te doden.
In immune dieren die een effectieve afweer tegen een bepaalde tumor hebben wordt deze
immuniteit meestal veroorzaakt door de verschillende T-cellen. Deze T-cellen circuleren met
de bloed- en lymfestroom door alle weefsels, en herkennen specifiek tumorcellen.
Ook antistoffen circuleren door alle weefsels.
Recent onderzoek in proefdieren heeft
aangetoond dat deze soms ook een bijdrage kunnen leveren voor immuniteit.
Immune dieren stoten ook alle uitzaaiingen van dezelfde kanker af.
Immuniteit tegen kanker is dus de meest ideale manier om de niet-operatief-verwijderbare
uitzaaiingen op te ruimen.
Vaccin tegen kanker
Vaccinatie is het meest geteste middel om het afweersysteem te stimuleren. Tegen virussen en bacteriŽn is vaccinatie het meest effectieve middel. Hierbij wordt, vůůr of op het moment van blootstelling, het afweersysteem gestimuleerd met dode of afgezwakte ziekteverwekkers of delen daarvan. Het afweersysteem reageert dan tegen die dode of afgezwakte vorm en wordt tegelijkertijd immuun tegen de echte ziekteverwekker.
In laboratoria wordt geprobeerd vaccins te maken tegen kanker. Meestal wordt dan geen
gebruik gemaakt van de dode tumorcellen, maar van het RNA of peptiden
(kleine stukjes eiwit) en tumor antigenen uit die kanker cellen.
In de strijd tegen kanker worden de beste APC's - antigeen presenterende cellen
(dendritische cellen) - gebruikt, maar de resultaten zijn nog niet zoals gewenst.
Een nadeel van vaccinatie tegen ziekteverwekkers is dat het weinig effectief is in het geval
van een al bestaande infectie. Een goed vaccin wordt preventief gegeven vůůrdat
blootstelling met de ziekteverwekkers plaatsvindt. Zodat je bij een besmetting niet ziek
zult worden.
Helaas is vaccinatie tegen spontane tumoren onmogelijk, gezien het feit dat er ontelbaar
veel mogelijke tumor antigenen zijn.
Het gevaar van ongevaarlijk zijn
In de strijd tegen kanker worden de nieuwste methodes voor co-stimulatie
gebruikt.
Co-stimulatie is nodig voor de ontwikkeling van een goede afweer-respons, zonder co-stimulatie
kan het lichaam zelfs actief tolerant worden tegen het vaccin.
Co-stimulatie is nodig omdat het afweersysteem niet op alle lichaamsvreemde stoffen reageert.
Neem bijvoorbeeld ons dagelijks voedsel en de meeste stoffen (stofdeeltjes uit de lucht)
waarmee wij in aanraking komen.
De enige uitzondering hierop zijn de stoffen waarvoor je allergisch bent!
Behalve dat een binnenkomend stofje lichaamsvreemd is, heeft het lichaam blijkbaar ook een
signaal nodig dat aangeeft dat dit stofje ook daadwerkelijk gevaarlijk is.
Het afweersysteem heeft twee methodes om 'gevaar' te zien.
- Schimmels, bacteriŽn en virussen worden door het lichaam herkend als 'gevaar' op
grond van hun specifieke structuur (zie iets terug 'Het ontstaan van specifieke afweer').
Omdat tumorcellen ontstaan uit lichaamscellen, hebben ze dergelijke specifieke structuren niet.
- Een tweede vorm van 'gevaar' zijn signalen die te maken hebben met schade in het
lichaam.
Bij schade in het lichaam kun je denken aan dode cellen, de aanwezigheid van vrije radicalen
(instabiele en zeer agressief reagerende stoffen), en stress-eiwitten.
Beide vormen van 'gevaar' leiden tot de aanmaak van co-stimulerende moleculen op de APC's,
waardoor een goede afweer respons ontstaat.
Uitzaaiende tumoren veroorzaken doorgaans veel schade waardoor ze makkelijker door lichaam
opgemerkt worden. Maar jonge tumoren zijn vaak klein en veroorzaken weinig schade.
De mogelijkheid bestaat dan dat de nog jonge tumor wel herkend wordt door het afweersysteem.
Maar dat het afweersysteem 'besluit' dat de tumor beschermd moet worden, als ware het
lichaamseigen.
Het lichaam maakt dan T-cellen die weliswaar de tumor herkennen, maar afweerreacties daartegen
remmen. Dit is weer een vorm van actieve tolerantie. Ofschoon latere co-stimulatie de
tolerantie kan doorbreken, ligt het aan de krachtsverhouding tussen co-stimulatie en
tolerantie of dit daadwerkelijk gebeurt.
Doorbreken van tolerantie
Een relatief eenvoudige en vaak effectieve manier om tolerantie te doorbreken is
passief vaccineren, dat wil zeggen, antistoffen of T-cellen tegen de tumor in de patiŽnt
spuiten.
Studies in proefdieren laten zien dat tumor immune dieren dit meestal zijn vanwege
de aanwezigheid van T-cellen. Helaas is het erg moeilijk om goed functionerende T-cellen
op een effectieve manier buiten het lichaam te maken.
Antistoffen daarentegen kunnen tegenwoordig wel goed buiten het lichaam worden gemaakt met
behulp van fagen. Fagen zijn virussen die bacteriŽn infecteren en zich daarin gemakkelijk
laten vermeerderen. Deze fagen worden genetisch veranderd met alle mogelijk verschillende
antistoffen die een mens kan maken. Zo'n faagbank, zoals dat genoemd wordt, kan uit
wel 1011 verschillende fagen bestaan.
Door vervolgens te selecteren op de fagen die wel aan de tumorcellen maar niet aan gewone
cellen binden, kunnen in de reageerbuis menselijke antistoffen worden gemaakt die alleen
aan de kankercellen binden.
Via moleculair biologische technieken kunnen van die fagen, menselijke antistoffen (1) worden
gemaakt opdat ze geschikt zijn om kankercellen te doden gebruikmakend van verschillende
mogelijke natuurlijke afweermechanismen.
Kleine delen van antistoffen (2) gecombineerd met giftige of radioactieve stoffen kunnen beter
in het weefsel doordringen dan volledige antistoffen. De antistoffragmenten zorgen dan
dat de giftige of radioactieve stof in de tumor komt, waardoor deze selectief wordt gedood.
Een derde strategie met antistoffen (3) maakt gebruik van twee antistoffen die aan elkaar
gekoppeld zijn, de ene bindt aan de tumor, de ander aan een cel die de tumor kan
doden.
Aangezien antistoffen vaak geen belangrijke rol spelen bij de tumor immune proefdieren, is het niet duidelijk hoe effectief antistoffen in de strijd tegen kanker zijn. Misschien komt dit omdat vele antistoffen niet of slechts moeizaam in het tumorweefsel kunnen doordringen. Dat zou verklaren waarom antistoffen tezamen met cellulaire afweer (T-cellen) tot een betere afweer tegen kanker leiden dan de celdodende T-cellen alleen.
Uithongeren
Een andere manier om kanker te bestrijden is indirect, namelijk door het vernietigen van de
voedsel- en zuurstof aanvoer van het gezwel. Voedsel en zuurstof wordt aangevoerd via de
bloedvaten, die in tumoren jonger en anders zijn dan in normaal weefsel.
Daarom zijn deze bloedvaten gevoeliger voor aanvallen van het afweersysteem.
De bloedtoevoer naar tumoren kan worden gesaboteerd door de bloedvatwanden te vernietigen,
de aanmaak van bloedvaten te remmen, de bloedsomloop te stoppen door stolling, of de
uitwisseling van stoffen met het omringende weefsel te verhinderen door het veroorzaken van
tegendruk in het weefsel (oedeem).
De meeste therapieŽn richten zich vooralsnog op de eerste twee strategieŽn.
Tumor bloedvatwanden (endotheel) worden vernietigd met behulp van antistoffen. Cytokines die de aanmaak van bloedvaten remmen, worden met succes gebruikt in proefdieren, maar nog niet in patiŽnten. Het vernietigen van de bloedaanvoer kan een effectief middel zijn tegen grote en middelgrote tumoren die afhankelijk zijn van tumorbloedvaten. Kleine uitzaaiingen, die niet afhankelijk zijn van tumorbloedvaten, worden echter niet gedood bij deze therapie, waardoor de tumor slechts ten dele wordt opgeruimd. Misschien dat een combinatie van anti-bloedvat therapie en antistoffen tegen de tumor effectiever is.
Sturen van het afweersysteem
Cytokines zijn het communicatiemiddel tussen cellen van het afweersysteem onderling.
Cytokine-therapie (het toedienen van specifieke cytokines) is de meest voor de hand
liggende aanpak als je de toonzetting van de afweer wilt veranderen.
Sommige cytokines kunnen aanzetten tot het direct doden van cellen, andere tot het maken
van specifieke afweercellen, weer andere tot de productie van antistoffen en nog weer
andere tot tolerantie. Met toedienen van cytokines kan het afweersysteem worden gestuurd.
Het afweersysteem heeft verschillende manieren om tumoren op te ruimen, de ene methode is
effectiever dan de andere. Hoewel antistoffen een bijdrage kunnen leveren aan het doden van
tumor cellen, denken de meeste wetenschappers dat de beste afweer tegen tumoren de cellulaire
afweer betreft.
Cellulaire afweer bestaat voornamelijk uit helper T-cellen en celdodende T-cellen.
Deze afweer ontstaat in een zogenaamd type 1 cytokine milieu, terwijl
een type 2 cytokine milieu antistofproductie bevordert (zie afbeelding 1).
Voor het sturen van beginnende afweerreacties zijn kleine hoeveelheden cytokines nodig, en
nadat een afweerreactie is begonnen worden dezelfde cytokines in grotere hoeveelheden gemaakt
om de afweerreactie in stand te houden. In geval van een bestaande tumor is er meestal al
een afweerreactie in een bepaalde richting. Zo'n afweerreactie houdt zichzelf in stand met
de productie van bepaalde cytokines.
Door die sturende cytokines kan de afweerreactie meestal niet meer worden veranderd,
zelfs niet door het toedienen van grotere hoeveelheden andere cytokines.
 |
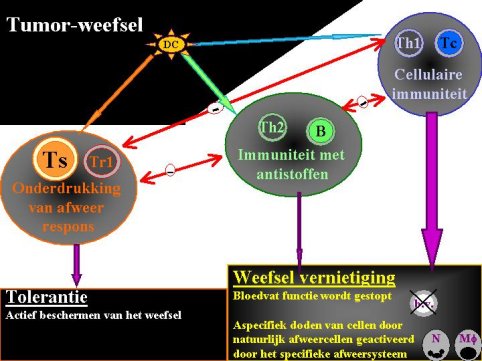
Afb. 2: De wisselwerking tussen tumor en afweersysteem: De dendritische cel (DC) in de tumor neemt tumor antigenen op. Vervolgens kan deze op drie manieren het afweersysteem aanzetten. Ten eerste (volg blauwe lijn) kan de cellulaire afweer worden aangezet. In dit geval worden type 1 cytokines gemaakt door de helper T-cellen (Th1). Th1 cellen stimuleren de vorming van cytotoxische (celdodende) T-cellen (Tc). Deze Tc-cellen kunnen de tumorcellen doden. Ten tweede (volg groene lijn) kan de antistofproductie worden aangezet. Eerst worden type 2 cytokines gemaakt door de helper T-cellen (Th2). Deze cytokines stimuleren de aanmaak van antistoffen door B-cellen (B). De antistoffen (die in het bloed en de weefselvloeistof terechtkomen) kunnen de tumorcellen doden, maar zijn daarin niet het meest actief. Behalve het aanzetten tot direct doden kunnen de cytokines van Th1- , Th2- en Tc-cellen zorgen dat bloedvaten (b.v.) niet meer functioneel zijn, of dat cellen van het natuurlijke afweersysteem (N = neutrofiele granulocyt; Mf = macrofaag) de tumor doden. Dit is de meest efficiŽnte manier om een tumor te doden. De derde mogelijkheid (volg oranje lijn) is dat helper T-cellen de afweerreactie gaan beperken en regulerende T-cellen worden (Tr1). Deze Tr1 zorgen voor de aanmaak van afweeronderdrukkende suppressie T-cellen (Ts), waardoor een actieve vorm van tolerantie ontstaat en de tumor beschermt wordt door het afweersysteem. De drie verschillende mogelijke afweerreacties remmen elkaar in functie, hetgeen aangegeven is met de rode lijnen met een minnetje (θ) erin. |
Opzwepen van het afweersysteem
Het eerst-gebruikte anti-kanker cytokine (als medicijn) is Interleukine-2 (IL-2) en
wordt al sinds de 80-er jaren gebruikt. IL-2 stimuleert verschillende typen cellen die
tumoren doden.
Een ander bekend voorbeeld is Tumor Necrose Factor alfa (TNF-α), een stof bekend om
zijn dodelijke werking voor cellen.
Het nadeel van cytokines is dat ze het hele afweersysteem regelen en vele verschillende
cellen beÔnvloeden, waardoor cytokines nogal wat bijwerkingen vertonen. TNF-α is reeds
in zeer lage dosis giftig voor vele cellen.
IL-2 veroorzaakt in patiŽnten lekkage van de bloedvaten, waardoor een dodelijk lage bloeddruk kan ontstaan. IL-2 kan Natural killer (NK) cellen stimuleren, in hun natuurlijke afweer tegen tumoren en bevordert ook de vorming van specifieke T-cellen. Een mogelijke oplossing is om NK-cellen in een reageerbuis met cytokines te behandelen, alvorens ze terug te geven aan de patiŽnt. Het therapeutisch effect hiervan is echter gering, omdat de activiteiten van IL-2 om T-cellen te stimuleren hierbij niet worden gebruikt.
Krabben waar het jeukt
Gezien de veelvoud van acties zijn cytokines een interessante methode voor anti-kanker therapie,
indien de bijwerkingen verminderd kunnen worden. Een mogelijkheid om dat te doen is de
cytokines lokaal toe te dienen waar ze nodig zijn, dus in of in de buurt van de tumor.
Dit heeft als voordeel dat de concentratie cytokines in de tumor hoog blijft, maar dat de
bijwerkingen sterk worden teruggedrongen. In een operatie kan de bloedstroom door de tumor
voorzien worden van TNF-α, zonder dat deze bloedstroom door het gehele lichaam gaat.
TNF-&alpha geeft dan een sterke vermindering van de tumorgrootte. Als IL-2 in of nabij een
gezwel word geÔnjecteerd kunnen tumoren met een grootte tot 5% van het lichaamsgewicht
verdwijnen.
Opmerkelijk genoeg, verdwijnt niet alleen het gezwel waar IL-2 is ingespoten, maar ook de
uitzaaiingen hiervan.
Lokale IL-2 therapie werkt bij verschillende proefdiermodellen, maar wordt ook succesvol
toegepast bij patiŽnten. Oogtumoren van runderen en blaastumoren van mensen kunnen effectief
bestreden worden met lokale IL-2 met goede genezingspercentages. Uit proefdierexperimenten
blijkt dat genezen dieren na lokale IL-2 therapie immuun zijn voor dat type kanker, maar niet
voor andere.
Helaas werkt lokale IL-2 therapie nog niet voor alle soorten kanker en is ook de timing van
toediening belangrijk. Om deze en andere therapieŽn te verbeteren is nog wel wat onderzoek
vereist.
Verbetering van anti-kanker therapie
Een aantal afweerstimulerende therapieŽn toont voor sommige tumoren goede resultaten. De veelvoud van cellen in het afweersysteem en hun onderlinge interacties en interacties met de tumor, maken het onmogelijk het gehele onderzoek in de reageerbuis te doen. Vandaar dat nieuwe geneesmiddelen of toedieningsmethodes op dieren of mensen moeten worden uitgetest, in proefdieren of zieke dieren en mensen.
In de Verenigde Staten is het voldoende om aan te tonen dat een middel niet giftig is voor
de patiŽnt; vervolgens worden mensen als proefdieren gebruikt.
Voordat een nieuw geneesmiddel tegen kanker in Nederland op menselijke patiŽnten mag worden
getest, moeten de therapie resultaten van dieren onder vergelijkbare omstandigheden met
vergelijkbare tumoren bekend zijn. Hiermee voorkomt Nederland dat menselijke patiŽnten
gebruikt worden als proefkonijn voor medicijnen die waarschijnlijk toch niet werken.
De weg van succesvolle laboratoriumproeven naar geneesmiddel kan gemakkelijk 15 tot
20 jaar beslaan.
Bronnen:
- J. G. van den Tweel e.a. (1988); Immunologie. Het menselijk afweersysteem. Natuur & Techniek.
- Maas, R., Dulens, H. F. J., De Jong W. H. & Den Otter, W., (1989) Immunotherapy of mice with a large burden of disseminated lymphoma with low-dose interleukin-2, Cancer Res. 49: 8037
- Den Otter, W., Steerenberg, P. A. & Van der Laan, J-W (2002) Testing therapeutic potency of anticancer drugs in animal studies: a commentary. Regulatory Toxicol. Pharmacol. 35: 266-272 (2002)